题目内容
2011 年3 月,日本福岛第一核电站发生核辐射泄漏,产生放射性碘-131.吸入放射碘可引发甲状腺疾病.世界卫生组织推荐,一定条件下服用100mg碘,可以减少放射性碘的吸收.试回答:
(1)已知碘的原子序数为53,碘-131原子的相对原子质量为131,则碘-131原子的核外电子数________、中子数为________.
(2)碘片的主要成分为碘化钾(KI),则碘化钾中碘元素的化合价为________.其中钾元素与碘元素的质量比为________.
| 配料 氯化纳、碘酸钾(KIO3) 含碘量 20~50mg/kg 保质期 18个月 食用方法 勿长时间炖炒 贮藏指南 避热、密封、防潮 |
服用100mg碘元素,至少需要食用________kg的食盐.由此,学过化学的你,对抢购食盐的做法进行分析判断________.
(4)厨房内调味品除了食用碘盐,还有葡萄糖等.已知葡萄糖的化学式为C6H12O6,则葡萄糖中氧元素的质量分数为________
(5)山茶油是一种绿色保健品,其主要成分是柠檬醛.现从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成220g二氧化碳和72g水,则柠檬醛的化学式是________.
解:(1)由题意“碘的原子序数为53,碘-131原子的相对原子质量为131”,则根据“相对原子质量≈质子数+中子数(近似整数值)”“原子序数=核内质子数=核外电子数=核电荷数”,则碘-131原子的核外电子数是 53,核内中子数是 131-53=78.
故答案为:53、78.
(2)根据化学式KI,由化合物中各元素化合价代数和为0,则其中I元素的化合价为:(+1)×1+x=0;x=-1;其中K、I元素的质量比=39:127;
故答案为:-1、39:127
(3)根据标签,该食盐含碘元素含量最大值为50mg/kg,因此含有100mg碘元素的食盐的最小质量=100mg÷50mg/kg=2kg;每个人每天不可能食盐2kg的食盐,即加碘盐含碘很低,通过食用加碘盐的方法不能预防辐射,因此该做法是不正确的;
故答案为:2、这种做法是不对的,加碘食盐含碘量低,不能预防辐射
(4)葡萄糖中氧元素的质量分数为 ×100%=53.3%,
×100%=53.3%,
故答案为:53.3%;
(5)解:柠檬醛中C、H、O的质量分别是
C:220g×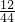 ×100%=60g,
×100%=60g,
H:72g× ×100%=8g,
×100%=8g,
O:76g-60g-8g=8g,
碳元素、氢元素、氧元素的质量比为60g:8g:8g=15:2:2.
设该化合物的化学式为CxHyOz.根据有机物中,碳元素、氢元素、氧元素的质量比为:15:2:2,则有12x:y:16z=15:2:2,
解得:x:y:z=10:16:1,
有机物的化学式是C10 H16 O.
故答案为:C10 H16 O.
分析:(1)熟记规律:相对原子质量≈质子数+中子数(近似整数值);“原子序数=核内质子数=核外电子数=核电荷数”.
(2)根据物质的化学式,由各元素化合价代数和为0计算碘元素化合价,利用各的相对相对原子质量计算组成元素质量比;
(3)根据标签中食盐中碘元素的含量,计算含有一定碘元素的食盐的质量;并结合常识,对行为进行评价;
(4)根据葡萄糖的化学式为C6H12O6和物质中某元素的质量分数= ×100%,进行解答本题.
×100%,进行解答本题.
(5)根据二氧化碳的质量和二氧化碳中碳元素的质量分数,即可计算出生成物中碳元素的质量;根据水的质量和水中氢元素的质量分数,即可计算出生成物中氢元素的质量;根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.柠檬醛的质量减去二氧化碳和水中碳、氢元素的质量就是生成物中氧元素的质量,根据组成元素的质量比可以判断物质的化学式.
点评:了解原子的定义和构成,主要利用习题中葡萄糖的化学式来进行计算,学生只要熟悉原子的相对原子质量及计算方法来解答即可.
故答案为:53、78.
(2)根据化学式KI,由化合物中各元素化合价代数和为0,则其中I元素的化合价为:(+1)×1+x=0;x=-1;其中K、I元素的质量比=39:127;
故答案为:-1、39:127
(3)根据标签,该食盐含碘元素含量最大值为50mg/kg,因此含有100mg碘元素的食盐的最小质量=100mg÷50mg/kg=2kg;每个人每天不可能食盐2kg的食盐,即加碘盐含碘很低,通过食用加碘盐的方法不能预防辐射,因此该做法是不正确的;
故答案为:2、这种做法是不对的,加碘食盐含碘量低,不能预防辐射
(4)葡萄糖中氧元素的质量分数为
 ×100%=53.3%,
×100%=53.3%,故答案为:53.3%;
(5)解:柠檬醛中C、H、O的质量分别是
C:220g×
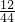 ×100%=60g,
×100%=60g,H:72g×
 ×100%=8g,
×100%=8g,O:76g-60g-8g=8g,
碳元素、氢元素、氧元素的质量比为60g:8g:8g=15:2:2.
设该化合物的化学式为CxHyOz.根据有机物中,碳元素、氢元素、氧元素的质量比为:15:2:2,则有12x:y:16z=15:2:2,
解得:x:y:z=10:16:1,
有机物的化学式是C10 H16 O.
故答案为:C10 H16 O.
分析:(1)熟记规律:相对原子质量≈质子数+中子数(近似整数值);“原子序数=核内质子数=核外电子数=核电荷数”.
(2)根据物质的化学式,由各元素化合价代数和为0计算碘元素化合价,利用各的相对相对原子质量计算组成元素质量比;
(3)根据标签中食盐中碘元素的含量,计算含有一定碘元素的食盐的质量;并结合常识,对行为进行评价;
(4)根据葡萄糖的化学式为C6H12O6和物质中某元素的质量分数=
 ×100%,进行解答本题.
×100%,进行解答本题.(5)根据二氧化碳的质量和二氧化碳中碳元素的质量分数,即可计算出生成物中碳元素的质量;根据水的质量和水中氢元素的质量分数,即可计算出生成物中氢元素的质量;根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.柠檬醛的质量减去二氧化碳和水中碳、氢元素的质量就是生成物中氧元素的质量,根据组成元素的质量比可以判断物质的化学式.
点评:了解原子的定义和构成,主要利用习题中葡萄糖的化学式来进行计算,学生只要熟悉原子的相对原子质量及计算方法来解答即可.

练习册系列答案
相关题目
 (1)2011年3月11日,日本发生9.0级大地震,造成数百万人饮水困难.水是生命之源.认识水资源、合理利用和保护水资源是我们义不容辞的责任.
(1)2011年3月11日,日本发生9.0级大地震,造成数百万人饮水困难.水是生命之源.认识水资源、合理利用和保护水资源是我们义不容辞的责任.