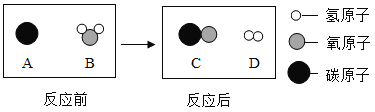
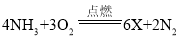题目内容
【题目】1949年10月1日中华人民共和国成立,在开国大典上首次实现了电动升国旗。为保证国旗不被卷入,要求旗杆上的“阻断球”要足够结实,不易被撞裂。在“阻断球”的制作过程中不仅使用了铁,还熔入了一定比例的铬(Cr)等金属,这是利用了合金____________________的性质。在常见金属活动性顺序中没有铬,同学们决定对铬与常见金属镁和铜的活动性强弱进行探究。
(查阅资料)铬(Cr)是一种银白色金属,其化合物硫酸亚铬(CrSO4)的水溶液呈蓝色。硫酸亚铬中铬元素的化合价为___________。
(提出猜想)三种金属的活动性强弱为:
猜想一:Cr>Mg>Cu;
猜想二:__________;
猜想三:Mg>Cu>Cr
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
①分别向盛有Cr和Cu两种金属片的试管中加入同体积同浓度的稀硫酸 | 只有盛________的试管中有气泡产生,并得到蓝色溶液 | 猜想三错误 |
②向盛有硫酸镁溶液的试管中加入金属Cr | 无明显现象 | 猜想______正确 |
(交流与讨论)
(1)实验前所用的金属片都需用砂纸打磨,目的是_________。
(2)实验①中发生反应的化学方程式为__________。
(3)结合探究结论,有同学提出上述三个实验可进行优化,只需选择三种药品,即可判断金属的活动性强弱。合理的选择是__________(选填序号)。
①硫酸镁溶液 ②硫酸亚铬溶液 ③硫酸铜溶液 ④稀硫酸 ⑤镁片 ⑥铬片 ⑦铜片
(拓展延伸)若将步骤①和②中反应后的混合物倒入同一烧杯中, 搅拌、过滤,得到固体X和溶液Y。则:
(1)溶液Y中溶质的成分__________(选填序号)。
A一定有MgSO4
B一定有CrSO4
C可能有H2SO4
D可能有CuSO4
(2)过滤过程中,用到的玻璃仪器有烧杯、玻璃棒和__________,其中玻璃棒的作用是__________。
【答案】硬度比组成它的纯金属大 +2 Mg>Cr>Cu 铬(或Cr) 二 除去表面的氧化膜(合理即可) ![]() ①③⑥(或②⑤⑦) ABC 漏斗 引流
①③⑥(或②⑤⑦) ABC 漏斗 引流
【解析】
在“阻断球”的制作过程中不仅使用了铁,还熔入了一定比例的铬(Cr)等金属,不易被撞裂。这是利用了合金硬度比组成它的纯金属大的性质;
查阅资料:
铬(Cr)是一种银白色金属,其化合物硫酸亚铬(CrSO4)的水溶液呈蓝色。硫酸亚铬中硫酸根的化合价为-2价,根据化合物中各元素的化合价代数和为零可知,铬元素的化合价为+2;
提出猜想:
已知镁的活动强于铜,三种金属的活动性强弱为:
猜想一:Cr>Mg>Cu;
猜想二:Mg>Cr>Cu;
猜想三:Mg>Cu>Cr
进行实验:
①若猜想三错误,说明Cr的活动性大于Cu,分别向盛有Cr和Cu两种金属片的试管中加入同体积同浓度的稀硫酸,只有盛铬(或Cr)的试管中有气泡产生,并得到蓝色溶液;
②向盛有硫酸镁溶液的试管中加入金属Cr,无明显现象,说明镁的活动性大于铬,猜想二正确;
交流与讨论:
(1)实验前所用的金属片都需用砂纸打磨,目的是除去表面的氧化膜,防止氧化膜干扰实验;
(2)实验①中发生的反应是铬与硫酸反应生在成硫酸亚铬和氢气,反应的化学方程式为![]() ;
;
(3)利用①③⑥,把铬片分别放入硫酸镁、硫酸铜溶液中,伸入硫酸镁溶液中的铬片,无明显现象,说明镁比铬活泼;伸入硫酸铜溶液中的铬片,表面析出红色固体,说明铬比铜活泼;
利用②⑤⑦,把镁片、铜片分别伸入硫酸亚铬溶液中,镁片表面析出银白色固体,说明镁比铬活泼,铜片表面无明显现象,说明铬比铜活泼。故填:①③⑥(或②⑤⑦);
拓展延伸:
步骤①中反应后的混合物一定含有CrSO4、Cu,可能有H2SO4、Cr中的一种;步骤②中反应后的混合物中一定存在MgSO4和Cr,倒入同一烧杯中, 搅拌,能发生的反应是步骤①硫酸与步骤②Cr反应生成CrSO4。过滤,得到固体X和溶液Y。
(1)溶液Y中溶质的成分一定有MgSO4,一定有CrSO4,可能有H2SO4,不可能有CuSO4。故选ABC;
(2)过滤过程中,用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流。

【题目】为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁,然后将100g稀硫酸平均分五次加入,测得加入稀疏酸质量与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸反应)
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
产生氢气的累计质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是_________?(写出计算过程,结果精确到0.1%)
(3)请根据数据和计算结果,在下图坐标中画出对应的曲线图______。
【题目】某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究活动,并填空:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了两组对比实验:
I将3.0g氯酸钾和0.5 g二氧化锰粉末均匀混合加热
II将3.0g氯酸钾和Xg氧化铜粉末均匀混合加热
①在相同条件下比较上述两组实验产生氧气的快慢,实验II中X的值应为___________。
②若氧化铜可以催化氯酸钾分解,写出反应的化学方程式____________。
(2)乙同学探究“红砖粉末是否也可以作为过氧化氢分解的催化剂”。
[提出问题]红砖粉末能不能做“过氧化氢分解”的催化剂呢?
[做出猜想]红砖粉末能做“过氧化氢分解”的催化剂。
[实验验证]
实验步骤 | 实验现象 | 实验结论 |
①将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢分解速率很慢 |
②在上述试管中加入0.2g红砖粉末,然后将带火星的木条伸入试管中 | 木条复燃 | ①__________________, |
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管 | 在化学反应前后,红砖粉末的②____________没有改变。 |
[实验讨论]
有同学认为:仅凭上述实验还不能证明红砖粉末能做过氧化氢分解的催化剂,还需要增加一个实验。 将实验后剩余固体提纯后称量,如果所得固体的质量等于0.2g,则说明红砖粉末可以作为过氧化氢分解的催化剂。
[实验拓展]查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是____________(填字母)。
A催化剂能增加生成物的量
B在工业生产中催化剂起到极大的作用
C催化剂只能加快化学反应的速率
D同一个化学反应可以有多种催化剂