题目内容
(2006?苏州)取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为( )
【答案】分析:根据题干中“某温度下的氯化钾饱和溶液”可知,恒温蒸发10g水中最多可溶解4g氯化钾固体;也就是14克该溶液中溶质为4g;根据题意可知:“恒温蒸发10g水,析出4g氯化钾固体”后,剩余饱和溶液的质量为70-14=56g,设剩余溶液中溶质的质量为X;最后根据比例关系: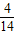 =
=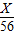 ,可计算出X.
,可计算出X.
解答:解:由题意“70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体”,则剩余饱和溶液的质量=70-10-4=56g,设该剩余溶液的溶质的质量为X,由因为“10g水,析出4g氯化钾固体”可知14克该饱和溶液中溶质4克氯化钾固体;根据题意列出如下比例关系:
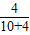 =
=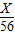
X=16g
答:则剩余溶液中所含溶质质量为16g
故选:A
点评:本题考查了饱和溶液中溶质的质量、溶剂、溶液质量之间的关系,此题要抓住“恒温蒸发10g水,析出4g氯化钾固体”这句话旨在告诉我们:14克饱和溶液中溶质的质量为4克,根据这句话就很好列出比例关系进行计算了.
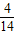 =
=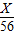 ,可计算出X.
,可计算出X.解答:解:由题意“70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体”,则剩余饱和溶液的质量=70-10-4=56g,设该剩余溶液的溶质的质量为X,由因为“10g水,析出4g氯化钾固体”可知14克该饱和溶液中溶质4克氯化钾固体;根据题意列出如下比例关系:
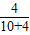 =
=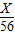
X=16g
答:则剩余溶液中所含溶质质量为16g
故选:A
点评:本题考查了饱和溶液中溶质的质量、溶剂、溶液质量之间的关系,此题要抓住“恒温蒸发10g水,析出4g氯化钾固体”这句话旨在告诉我们:14克饱和溶液中溶质的质量为4克,根据这句话就很好列出比例关系进行计算了.

练习册系列答案
相关题目
(
苏州,2006)取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为[
]|
A .16g |
B .20g |
C .40g |
D .56g |
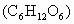 在体内经缓慢氧化生成二氧化碳和水,释放出热量.每90g葡萄糖完全氧化,可以产生大约1402kJ热量.若500g 5%葡萄糖注射液中的葡萄糖完全氧化,至少消耗氧气多少克?大约释放多少千焦热量?(计算结果取整数)
在体内经缓慢氧化生成二氧化碳和水,释放出热量.每90g葡萄糖完全氧化,可以产生大约1402kJ热量.若500g 5%葡萄糖注射液中的葡萄糖完全氧化,至少消耗氧气多少克?大约释放多少千焦热量?(计算结果取整数)
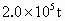 ,可节约煤
,可节约煤 .假设燃料中的硫元素经燃烧后全部转化为
.假设燃料中的硫元素经燃烧后全部转化为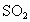 ,试计算该发电厂燃烧秸秆比燃烧煤每年少排放
,试计算该发电厂燃烧秸秆比燃烧煤每年少排放