题目内容
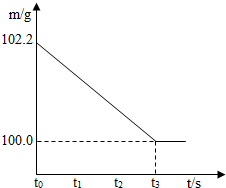 (2009?包头)将碳酸钠和硫酸钠的固体混合物12.2g放入烧杯中,再加入一定质量的稀硫酸使其恰好反应,测得反应后所得溶液中溶质质量分数为17.5%,烧杯和所盛物质的总质量(m)与反应时间(t)的关系如右图所示.计算:
(2009?包头)将碳酸钠和硫酸钠的固体混合物12.2g放入烧杯中,再加入一定质量的稀硫酸使其恰好反应,测得反应后所得溶液中溶质质量分数为17.5%,烧杯和所盛物质的总质量(m)与反应时间(t)的关系如右图所示.计算:(1)原固体混合物中碳酸钠的质量分数(精确到0.1%).
(2)所用稀硫酸中溶质质量分数.
分析:质量守恒定律的内容是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和.本题中碳酸钠和硫酸钠的固体,加入硫酸后,只有碳酸钠反应,硫酸钠不反应.根据题目信息和图象,可以求出二氧化碳的质量.根据二氧化碳的质量可以求出碳酸钠的质量、硫酸溶质的质量和生成的硫酸钠的质量,然后再求碳酸钠的质量分数.再根据质量分数求硫酸溶液的质量,然后求稀硫酸中溶质质量分数.
解答:解:根据质量守恒定律,二氧化碳的质量=102.2g-100g=2.2g
设碳酸钠的质量为x,硫酸溶质的质量为y,生成的硫酸钠的质量为z
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 98 142 44
x y z 2.2g
=
x=5.3g
×100%≈43.4%
=
y=4.9g
=
z=7.1g
反应后所得溶液中硫酸钠的质量为:7.1g+(12.2g-5.3g)=14g
所得溶液质量:
=80g
稀硫酸的质量=80g+2.2g-12.2g=70g
×100%=7%
答:原固体混合物中碳酸钠的质量分数为:43.4%;所用稀硫酸中溶质质量分数为7%
设碳酸钠的质量为x,硫酸溶质的质量为y,生成的硫酸钠的质量为z
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 98 142 44
x y z 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
| 5.3g |
| 12.2g |
| 98 |
| y |
| 44 |
| 2.2g |
| 142 |
| z |
| 44 |
| 2.2g |
反应后所得溶液中硫酸钠的质量为:7.1g+(12.2g-5.3g)=14g
所得溶液质量:
| 14g |
| 17.5% |
稀硫酸的质量=80g+2.2g-12.2g=70g
| 4.9g |
| 70g |
答:原固体混合物中碳酸钠的质量分数为:43.4%;所用稀硫酸中溶质质量分数为7%
点评:本考点既考查了根据化学方程式的计算,又考查了溶质的质量分数和质量守恒定律,属于含杂质的计算,综合性比较强,属于图象型计算题,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,杂质是否溶于水、是否反应等问题.本考点主要出现在填空题和计算题中.

练习册系列答案
相关题目


