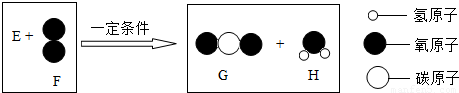
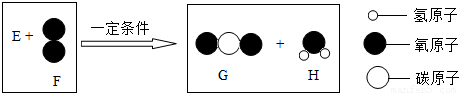
题目内容
把一定质量的纯净物E和40g的纯净物F,如图进行反应.反应结束后,可生成44g G物质和9g H物质.下列关于该反应的说法正确的是反应前反应后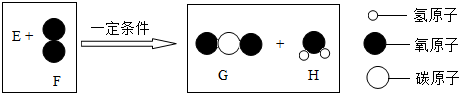
- A.9gH物质中氢元素的质量为2克
- B.E为含氧化合物
- C.G和H的分子个数比为1:2
- D.E分子中原子个数比为1:1
D
分析:A、根据分子构成图确定物质的化学式,利用化学式计算出9g物质H中所含氢元素的质量;
B、利用微观图及变化中各物质的质量,推断E物质的组成元素,对物质E的分类做出判断;
C、利用反应中生成两物质的质量及微观图确定物质的化学式所得到的相对分子质量,计算出该反应中两物质的分子个数比;
D、根据生成物的分子个数比可推断物质E中C、H原子个数比,但因数据不全面,无法判断分子中是否含氧原子.
解答:反应真正的关系图,如右:

通过计算可知44g二氧化碳含氧32g,9g水中含氧8g,含氢1g.所以可知E不含氧元素.
A、H分子为1个氧原子和2个氢原子构成的水分子,则9g水中氢元素的质量=9g×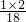 ×100%=1g,即9g物质H中含氢元素质量为1g,故A错误;
×100%=1g,即9g物质H中含氢元素质量为1g,故A错误;
B、根据反应生成物G、H的分子构成可判断两种生成物中共含C、H、O三种元素,而反应物F中只含O元素,根据化学变化前后元素种类不变,可判断反应E中一定含C、H两种元素,不能确定物质E中是否含O元素;再由生成44g G物质和9g H物质中含O的总质量=44g×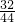 +9g×
+9g×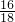 =40g,若40g氧气完全反应,E不含氧元素.故B不正确;
=40g,若40g氧气完全反应,E不含氧元素.故B不正确;
C、由微观图,可判断G为CO2、H为H2O,根据生成G物质44g、H物质9g,结合两物质的相对分子质量,可计算得出反应中物质G与H的分子个数比= =2:1;故C不正确;
=2:1;故C不正确;
D、根据示意图可以看出,E中原子个数比应该为1:1.故D正确;
故选D.
点评:此题因对反应物的质量未有明确说明,因此无法判断所要推断的反应物中是否含有氧元素,于是使题目的判断出现了其它可能因素.
分析:A、根据分子构成图确定物质的化学式,利用化学式计算出9g物质H中所含氢元素的质量;
B、利用微观图及变化中各物质的质量,推断E物质的组成元素,对物质E的分类做出判断;
C、利用反应中生成两物质的质量及微观图确定物质的化学式所得到的相对分子质量,计算出该反应中两物质的分子个数比;
D、根据生成物的分子个数比可推断物质E中C、H原子个数比,但因数据不全面,无法判断分子中是否含氧原子.
解答:反应真正的关系图,如右:

通过计算可知44g二氧化碳含氧32g,9g水中含氧8g,含氢1g.所以可知E不含氧元素.
A、H分子为1个氧原子和2个氢原子构成的水分子,则9g水中氢元素的质量=9g×
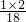 ×100%=1g,即9g物质H中含氢元素质量为1g,故A错误;
×100%=1g,即9g物质H中含氢元素质量为1g,故A错误;B、根据反应生成物G、H的分子构成可判断两种生成物中共含C、H、O三种元素,而反应物F中只含O元素,根据化学变化前后元素种类不变,可判断反应E中一定含C、H两种元素,不能确定物质E中是否含O元素;再由生成44g G物质和9g H物质中含O的总质量=44g×
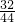 +9g×
+9g×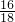 =40g,若40g氧气完全反应,E不含氧元素.故B不正确;
=40g,若40g氧气完全反应,E不含氧元素.故B不正确;C、由微观图,可判断G为CO2、H为H2O,根据生成G物质44g、H物质9g,结合两物质的相对分子质量,可计算得出反应中物质G与H的分子个数比=
 =2:1;故C不正确;
=2:1;故C不正确;D、根据示意图可以看出,E中原子个数比应该为1:1.故D正确;
故选D.
点评:此题因对反应物的质量未有明确说明,因此无法判断所要推断的反应物中是否含有氧元素,于是使题目的判断出现了其它可能因素.

练习册系列答案
相关题目
把一定质量的纯净物E和40g的纯净物F,如图进行反应.反应结束后,可生成44g G物质和9g H物质.下列关于该反应的说法正确的是反应前反应后( )

| A、9gH物质中氢元素的质量为2克 | B、E为含氧化合物 | C、G和H的分子个数比为1:2 | D、E分子中原子个数比为1:1 |
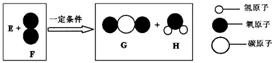 把一定质量的纯净物E和40g的纯净物F,按如图进行反应.反应结束后,可生成44g G物质和9g H物质.下列关于该反应的说法正确的是( )
把一定质量的纯净物E和40g的纯净物F,按如图进行反应.反应结束后,可生成44g G物质和9g H物质.下列关于该反应的说法正确的是( )