题目内容
我国化学家侯德榜发明了一种著名的纯碱生产方法----“联合制碱法”.(1)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③2NaHCO3=Na2CO3+H2O+CO2↑
该过程中没有涉及的基本反应类型是
(2)第②步中加入的是磨细食盐粉,食盐磨细的目的是
(3)上述方法制得的纯碱产品中常含有少量的氯化钠.某研究性学习小组对刚生产出的纯碱产品进行检测.取22克该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断振荡.
首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;
然后发生的反应是:NaHCO3+HCl=NaCl+H2O+CO2↑.
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示.
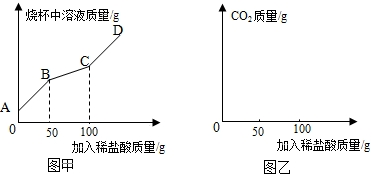
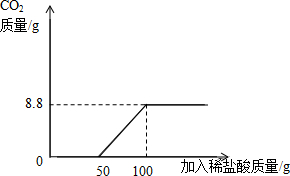
①请你根据图甲提供的信息,在图乙的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线.(标明二氧化碳质量的相应数值)
②计算该样品中纯碱的质量分数.(计算结果用百分数表示,保留到小数点后一位)
分析:根据碳酸钠的制取过程进行分析,(1)分析反应的化学方程式即可知道反应的类型,(2)固体颗粒的大小影响反应的速度,副产物为氯化铵,属于氮肥,(3)①计算出开始产生二氧化碳的点和不再产生二氧化碳的点即可绘得变化的曲线,②要计算碳酸钠的质量分数,需要求得碳酸钠的质量.
解答:解:(1)①属于化合反应,②属于复分解反应,③属于分解反应,不涉及置换反应,所以本题答案为:置换反应;
(2)固体颗粒的大小影响反应的速度,副产物为氯化铵,属于氮肥,所以本题答案为:加快化学反应速率或加快食盐溶解,氮;
(3)①据图甲可以看出,当加入盐酸的量为50g时开始产生二氧化碳,当加入盐酸的量为100g时不再生成二氧化碳,设产生二氧化碳的质量为x,则有
NaHCO3+HCl=NaCl+H2O+CO2↑.
36.5 44
50g×14.6% x
=
x=8.8g
所以本题答案为:
(4)根据题意可以看出,与碳酸钠反应的盐酸共有100g,设碳酸钠的质量为y,则有
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
y 100g×14.6%
=
y=21.2g
所以该样品中纯碱的质量分数为:
×100%=96.4%
(2)固体颗粒的大小影响反应的速度,副产物为氯化铵,属于氮肥,所以本题答案为:加快化学反应速率或加快食盐溶解,氮;
(3)①据图甲可以看出,当加入盐酸的量为50g时开始产生二氧化碳,当加入盐酸的量为100g时不再生成二氧化碳,设产生二氧化碳的质量为x,则有
NaHCO3+HCl=NaCl+H2O+CO2↑.
36.5 44
50g×14.6% x
| 36.5 |
| 50g×14.6% |
| 44 |
| x |
x=8.8g
所以本题答案为:

(4)根据题意可以看出,与碳酸钠反应的盐酸共有100g,设碳酸钠的质量为y,则有
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
y 100g×14.6%
| 106 |
| y |
| 73 |
| 100g×14.6% |
y=21.2g
所以该样品中纯碱的质量分数为:
| 21.2g |
| 22g |
点评:本题考查了碳酸钠的制取以及有关的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目