题目内容
【题目】在学习盐酸的化学性质时,小明和小芳两位同学分别做了碳酸钠溶液和稀盐酸溶液的化学实验(如图).小明的实验中能观察到有气泡产生,小芳的实验中观察不到有气泡产生,对此意外现象,两位同学进行如下探究: 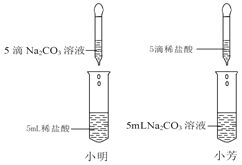
【提出问题】小芳的实验中为什么没有观察到明显现象?
【查阅资料】①碳酸钠和稀盐酸反应不仅可以生成二氧化碳,还可以生成碳酸氢钠.
②碳酸氢钠与氯化钙溶液混合不发生反应;而碳酸钠溶液与氯化钙溶液反应生成沉淀.
【设计实验】证明小芳实验的溶液中含有碳酸氢钠.
实验步骤 | 实验现象 | 实验结论 |
①取上述溶液少量于试管中,加入足量的 ________(写化学式)溶液 | 产生白色沉淀 | 小芳实验的溶液中 含有碳酸氢钠 |
②取步骤①所得上层清液少量,滴加 ______ | _______ |
写出步骤①反应的化学方程式: ______ .
【实验反思】(1)Na2CO3溶液和盐酸溶液反应的生成物受到盐酸量的影响,稀盐酸 ______ (填“过量”或“不足”)时才有气泡冒出.
(2)当反应物的量不同时,产物可能不同,试另举一例: ______ .
【答案】 CaCl2 稀盐酸 产生气泡 Na2CO3+CaCl2═CaCO3↓+2NaCl 过量 氧气足量时,碳燃烧生成二氧化碳,氧气不足时,碳燃烧生成一氧化碳
【解析】【设计实验】由资料:碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠:Na2CO3+CaCl2═CaCO3↓+2NaCl,现观察到产生了白色沉淀,故加入的是足量氯化钙溶液,足量的氯化钙溶液能将溶液中碳酸钠除去。由已有知识可知碳酸氢钠能与稀盐酸反应生成二氧化碳气体,故是加入稀盐酸,产生了大量的气泡,说明小芳实验的溶液中含有碳酸氢钠;【实验反思】(1)Na2CO3溶液和盐酸溶液反应先生成碳酸氢钠,盐酸有多,继续与生成的碳酸氢钠反应生成二氧化碳气体,故稀盐酸过量时才能观察到产生气泡的现象;(2)当反应物的量不同时,产物可能不同,如碳在氧气充足时燃烧生成二氧化碳,氧气不足时生成一氧化碳。
点睛:碳酸钠和碳酸氢钠均能与稀盐酸或稀硫酸反应生成二氧化碳气体。判断反应后溶液中溶质的成分,不仅要考虑生成物,还要考虑反应物的量。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】下列四个图像中,能正确表示对应变化关系的是 (_________)
|
|
|
|
A.向一定量稀盐 酸中加水稀释 | B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C.加热一定量的 高锰酸钾固体 | D.等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 |
A.A B.B C.C D.D





