题目内容
小丽同学在一次课外实验探究酸的化学性质时误将过氧化氢(H2O2)溶液当作酸与氧化铁(Fe2O3)粉末混合,发现有大量气泡产生。她联想到二氧化锰(MnO2)可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能否作为H2O2分解的催化剂。
【实验验证】小丽同学一次设计了三个实验
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,观察到木条没有复燃,说明H2O2溶液常温下分解缓慢。
实验二 在实验一的试管中加入wg Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,观察到木条复燃,说明 。
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为wg,说明 。
【实验结论】小丽同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
【反思评价】小江同学认为要证明小丽同学的结论正确,仅做这三个实验还不充分,需要补充一个探究实验,探究Fe2O3粉末的化学性质在反应前后没变.
【拓展】下表是同学们探究影响H2O2分解因素时所记录的部分数据:
用足量等体积H2O2溶液制取相同体积O2所需时间
| 浓度 时间/min 催化剂 | 30%H2O2 溶液 | 15%H2O2 溶液 | 5%H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
通过对表格中的数据进行分析,你能得出的结论是 。
【延伸】明同学看到Fe2O3也能做H2O2分解的催化剂,还联想到一种蓝色的CuSO4溶液也能做H2O2分解的催化剂,请你一起参与计算:
(1)CuSO4的相对分子质量 ;
(2)80gCuSO4与多少克Fe2O3含有相等质量的氧元素?(写出计算过程,结果精确到0.1)
实验二 说明 Fe2O3能加快H2O2的分解速率。
实验三 说明 Fe2O3的质量在化学反应前后没有发生改变 。
【拓展】相同条件下,MnO2的催化效果比Fe2O3好(或相同条件下,H2O2浓度越大,反应越快)。
【延伸】(1) 160 ;(2)106.7g(格式1分)
解析试题分析:(1) CuSO4的相对分子质量=64+32+16×4=160。
(2)80gCuSO4氧元素的质量=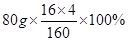
Fe2O3氧元素的质量分数=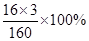 = 30% 32g/30%=106.7g
= 30% 32g/30%=106.7g
考点:催化剂实验的探究,利用化学式的计算。

研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶相同体积的H2O2溶液中分别加入相同质量MnO2和红砖粉,测量各生成一瓶(相同体积)O2所需要的时间。
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是 ,此实验中B处宜采用的气体收集方法是 。 
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2溶液 | 6% H2O2溶液 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 时间 | 152秒 | 35秒 |
 【结论】该探究过程得出的结论是 。
【结论】该探究过程得出的结论是 。【反思】H2O2在常温下分解缓慢,加入MnO2或红砖粉后反应明显加快,若要证明
MnO2和红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的 和 是否改变。
H2O2生成O2的快慢还与哪些因素有关?请你帮助他们继续探究。(只要求提出假设和实验方案)
【假设】 。
【实验方案】 。
学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂。
【实验验证】
| | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | |
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:
【实验目的】探究 。
【实验步骤】①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤, ,称量;
④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验四:
实验四的目的是探究 。
化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是 。
(2)对气体来源的探究:
甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
| 实验步骤及现象 | 结论 |
| 加热空的试管,另一端的澄清石灰水没有变浑浊 | 假设 (填“不成立”或“成立”) |
乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是 ,实验中观察到D处澄清石灰水变浑浊。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体。
 Na2CO3+H2O+CO2↑; NH4HCO3
Na2CO3+H2O+CO2↑; NH4HCO3



