题目内容
【题目】“侯氏制碱法”首先得到的是碳酸氢钠,然后将碳酸氢钠加热分解得到产品碳酸钠:2NaHCO3![]() Na2CO3+CO2↑+H2O.碳酸钠露置在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O=2NaHCO3.
Na2CO3+CO2↑+H2O.碳酸钠露置在空气中能与空气中的二氧化碳和水反应生成碳酸氢钠:Na2CO3+CO2+H2O=2NaHCO3.
某中学化学研究性学习小组对一瓶开启后久置的碳酸钠是否变质及变质程度进行研究.
【提出假设】 假设Ⅰ:完全变质;假设Ⅱ:没有变质;假设Ⅲ:________________.
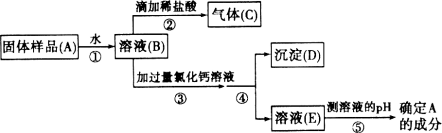
【实验探究】 实验一:取少量样品于试管中,加水溶解后再加入少量CaCl2溶液,产生白色沉淀,说明假设________不成立.反应的化学方程式为________________________.
实验二:取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品,有气体产生,澄清的石灰水变浑浊,说明假设________不成立.
【实验结论】 假设________成立,样品的成分是________.
【交流反思】 欲除去Na2CO3变质后产生的杂质,最合适的方法是________________________________.
【答案】【提出假设】部分变质
【实验探究】Ⅰ Na2CO3+CaCl2=CaCO3↓+2NaCl Ⅱ
【实验结论】Ⅲ 碳酸钠与碳酸氢钠
【交流反思】加热
【解析】碳酸钠的变质情况应该是完全变质、没有变质和部分变质,所以假设Ⅲ是部分变质;由于碳酸氢钠与氯化钙不能生成沉淀,加入氯化钙后产生白色沉淀,可知一定含有碳酸钠,所以假设Ⅰ不成立;由加热能生成二氧化碳气体可知一定含有碳酸氢钠,因此假设Ⅱ也不成立,据此可以判断样品的成分中既有碳酸钠又有碳酸氢钠,假设Ⅲ成立.根据碳酸氢钠可以加热生成碳酸钠的性质可以通过加热的方法除去碳酸钠中的碳酸氢钠杂质.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案