题目内容
现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并做相关记录.有关数据记录如下:| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
【答案】分析:因为铜不与硫酸反应,混合物中只有氧化亚铁与硫酸反应.由图表可知,第三次与第四次反应后剩余固体的质量相等,说明第三次反应已完全.剩余固体的质量就是混合物中铜的质量,据此计算即可.
解答:解:因为铜不与硫酸反应,氧化亚铁与硫酸完全反应后剩余固体就是铜,质量为8.0g.
那么10.0g此样品中铜的质量为:10.0g×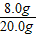 =4.0g.
=4.0g.
故答案为:4.0g.
点评:本题主要考查学生根据图表数据解答问题的能力.根据图表数据获得有效信息,在今天过程中可得到事半功倍的效果.
解答:解:因为铜不与硫酸反应,氧化亚铁与硫酸完全反应后剩余固体就是铜,质量为8.0g.
那么10.0g此样品中铜的质量为:10.0g×
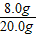 =4.0g.
=4.0g.故答案为:4.0g.
点评:本题主要考查学生根据图表数据解答问题的能力.根据图表数据获得有效信息,在今天过程中可得到事半功倍的效果.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并做相关记录.有关数据记录如下:
则:10.0g此样品中铜的质量是 .
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录.关数据记录如下表:
试计算:
(1)10.0g此样品中铜的质量.
(2)样品中氧化亚铁的质量分数.
(3)所用硫酸溶液溶质的质量分数.
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(1)10.0g此样品中铜的质量.
(2)样品中氧化亚铁的质量分数.
(3)所用硫酸溶液溶质的质量分数.
现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为1.22g/cm3的硫酸并做相关记录.关数据记录如下表:
试计算:
(1)10.0g此样品中铜的质量.
(2)样品中氧化亚铁的质量分数.
(3)所用硫酸溶液溶质的质量分数.
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(1)10.0g此样品中铜的质量.
(2)样品中氧化亚铁的质量分数.
(3)所用硫酸溶液溶质的质量分数.