题目内容
我市某中学化学兴趣小组为探究实验室制取氧气.把干燥、纯净的氯酸钾和二氧化锰的混合物30g装入大试管中,加热.(化学方程式为:2KClO3
| ||
| △ |
试计算:
(1)完全反应后制得氧气多少克?
(2)原混合物中氯酸钾的质量分数.(计算结果用百分数表示,保留到小数点后一位数字)
分析:根据质量守恒定律可知试管内物质质量的减少量就是生成的氧气的质量,根据方程式由氧气的质量,列比例式计算出参加反应的氯酸钾的质量,再除以原混合物的质量即可.
解答:解:(1)由于是完全反应,根据质量守恒,减少的质量就是生成的氧气的质量,即制得氧气:30g-20.4g=9.6g
(2)设氯酸钾质量为x:
2KClO3
2KCl+3O2↑
245 96
x 9.6g
=
x=24.5g
原混合物中氯酸钾的质量分数为:
×100%=81.7%
答:原混合物中氯酸钾的质量分数是81.7%.
故答案为:(1)9.6g;(2)81.7%.
(2)设氯酸钾质量为x:
2KClO3
| ||
| △ |
245 96
x 9.6g
| 245 |
| x |
| 96 |
| 9.6g |
x=24.5g
原混合物中氯酸钾的质量分数为:
| 24.5 |
| 30g |
答:原混合物中氯酸钾的质量分数是81.7%.
故答案为:(1)9.6g;(2)81.7%.
点评:做本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量进行进一步计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
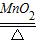 2KCl+3O2↑)待反应完全后,将试管冷却、称量,得到20.4g固体物质.
2KCl+3O2↑)待反应完全后,将试管冷却、称量,得到20.4g固体物质.