题目内容
(2007?宜昌)碳酸钙是牙膏中一种常用的摩擦剂,可用石灰石作原料来制备.宜昌市某牙膏厂现有一批石灰石样品,小丽为探究所含碳酸钙的质量分数,称取500g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为302g.(有关反应的化学方程式为:CaCO3 CaO+CO2↑,假设石灰石样品中杂质不参加反应.)
CaO+CO2↑,假设石灰石样品中杂质不参加反应.)据此我能计算:
(1)生成二氧化碳的质量;
(2)此石灰石样品中碳酸钙的质量分数.
【答案】分析:假设石灰石样品中杂质不参加反应,则高温煅烧石灰石样品500g至质量不再发生变化时,固体减轻的质量就是碳酸钙高温分解放出气体二氧化碳的质量;然后利用生成气体二氧化碳的质量,根据反应的化学方程式,计算出样品中碳酸钙的质量即可完成样品中碳酸钙质量分数的计算.
解答:解:根据质量守恒定律,二氧化碳的质量为:500g-302g=198g
设500g石灰石样品中碳酸钙的质量为x.
CaCO3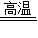 CaO+CO2↑
CaO+CO2↑
100 44
x 198g
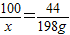 x=450g
x=450g
此石灰石样品中碳酸钙的质量分数为: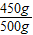 ×100%=90%
×100%=90%
答:(1)生成二氧化碳的质量为198g.(2)此石灰石样品中碳酸钙的质量分数为90%.
点评:根据变化中只放出气体二氧化碳,使用质量守恒定律,找出二氧化碳气体的质量是解决本题的关键.
解答:解:根据质量守恒定律,二氧化碳的质量为:500g-302g=198g
设500g石灰石样品中碳酸钙的质量为x.
CaCO3
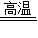 CaO+CO2↑
CaO+CO2↑100 44
x 198g
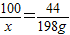 x=450g
x=450g此石灰石样品中碳酸钙的质量分数为:
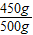 ×100%=90%
×100%=90%答:(1)生成二氧化碳的质量为198g.(2)此石灰石样品中碳酸钙的质量分数为90%.
点评:根据变化中只放出气体二氧化碳,使用质量守恒定律,找出二氧化碳气体的质量是解决本题的关键.

练习册系列答案
相关题目