题目内容
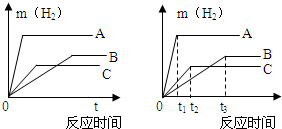
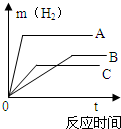 等质量的三种不同金属与足量稀酸反应,都生成相同价态的十2价硫酸盐,其反应情况如图所示,回答
等质量的三种不同金属与足量稀酸反应,都生成相同价态的十2价硫酸盐,其反应情况如图所示,回答(1)三种金属的活动性由强到弱的顺序是
(2)三种金属产生氢气由多到少的顺序是
(3)三种金属的相对原子质量由小到大的顺序是
分析:利用足量稀硫酸与等质量的三种金属完全反应,放出氢气的质量=
×金属质量;判断相对原子质量;根据相同时间内放出氢气的多少判断反应速率快慢,再利用反应速率判断金属活动性强弱.
| 金属化合价 |
| 金属相对原子质量 |
解答:解:(1)根据反应情况图,在停止反应前的同一时间,三种金属产生氢气质量从大到小的顺序为A>C>B,则金属A的反应速度最快,活动性最大,金属B的反应速度最慢,活动性则最小;
故答案为:A>C>B;
(2)根据图中的反应情况可以看出反应完全后,A生成的氢气最多,C生成的氢气最少.
故答案为:A>B>C
(3)由足量稀硫酸与等质量的三种金属完全反应,放出氢气的质量=
×金属质量可知:
三种金属的质量相等、化合价也相同,则产生氢气质量与相对原子质量成反比,所以完全反应后A放出氢气质量最大基,其相对原子质量最小,C产生氢气质量最小,相对原子质量最大;
故答案为:C>B>A.
故答案为:A>C>B;
(2)根据图中的反应情况可以看出反应完全后,A生成的氢气最多,C生成的氢气最少.
故答案为:A>B>C
(3)由足量稀硫酸与等质量的三种金属完全反应,放出氢气的质量=
| 金属化合价 |
| 金属相对原子质量 |
三种金属的质量相等、化合价也相同,则产生氢气质量与相对原子质量成反比,所以完全反应后A放出氢气质量最大基,其相对原子质量最小,C产生氢气质量最小,相对原子质量最大;
故答案为:C>B>A.
点评:质量相等的金属与足量酸完全反应放出氢气的多少与金属的相对原子质量成反比,与金属的化合价相成正比,这是解决此类题目常用的规律.

练习册系列答案
相关题目
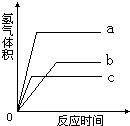 23、等质量的三种不同金属a、b、c分别和足量的溶质质量分数相同的稀硫酸反应,都生成相同价态硫酸盐,其反应情况如图所示.回答:
23、等质量的三种不同金属a、b、c分别和足量的溶质质量分数相同的稀硫酸反应,都生成相同价态硫酸盐,其反应情况如图所示.回答: