题目内容
【题目】工业上以粗盐(含少量MgCl2、CaCl2杂质)为原料,利用电解饱和食盐水的方法制备NaOH,其简要工艺流程如下:
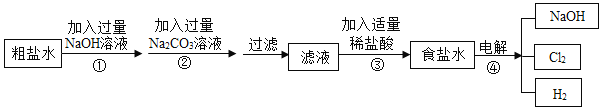
(1)步骤①中发生反应的基本反应类型是_____________反应.
(2)步骤③中加入适量稀盐酸的目的是_____________.
(3)验证步骤②中CaCl2已完全转化为CaCO3的方法是_____________.
(4)写出步骤④中反应的化学方程式_____________.
【答案】(1)复分解;(2)除去过量的氢氧化钠、碳酸钠;
(3)取反应后的滤液,加入碳酸钠,没有明显现象,证明氯化钙全部转化成碳酸钙沉淀;
(4)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
【解析】
试题分析:(1)步骤①中的反应是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,所以该反应是复分解反应;(2)除杂过程中加入的碳酸钠、氢氧化钠是过量的,对于氯化钠也是杂质,所以步骤③中加入适量稀盐酸的目的是除去过量的氢氧化钠、碳酸钠;(3)氯化钙和碳酸钠反应会生成碳酸钙沉淀和氯化钠,所以验证步骤②中CaCl2已完全转化为CaCO3的方法是取反应后的滤液,加入碳酸钠,没有明显现象,证明氯化钙全部转化成碳酸钙沉淀;(4)氯化钠溶液在通电的条件下生成氢氧化钠、氢气和氯气,化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。

练习册系列答案
相关题目