题目内容
【题目】向一定量CaCl2和HCl的混合溶液中,逐渐加入某浓度的Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图,下列说法错误的是
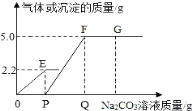
A. OE发生化学反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. Q点数值是P点数值的两倍
C. G点溶液的pH>7
D. E点和F点的溶液中溶质种类相同
【答案】D
【解析】
加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀。最后到达最高点说明已经完全反应。
A、图中OE段表示生成的气体质量,发生的碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,故选项说法正确,不符合题意;
B、由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应生成沉淀5.0g;设生成2.2g气体所需的Na2CO3的质量为x,生成沉淀5.0g所需Na2CO3的质量为y,
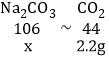
![]()
x=5.3g,
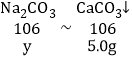
![]()
y=5.3g,则Q点数值是P点数值的两倍,故选项说法正确,不符合题意;
C、G点溶液中含有Na2CO3、NaCl两种溶质,由于Na2CO3显碱性,NaCl显中性,G点的溶液的pH>7,故选项说法正确,不符合题意;
D、E点的溶质是氯化钠、氯化钙,F点的溶液中溶质氯化钠,故选项说法错误,符合题意。
故选D。

练习册系列答案
相关题目