题目内容
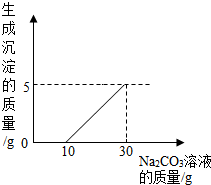
 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有
HCl
HCl
; (2)求Na2CO3溶液中溶质的质量分数.(计算结果精确到0.1%)
(3)求题(1)滤液中还含有溶质的质量.
分析:(1)由图象可知,在加入Na2CO3溶液的过程中,开始时没有发现生成沉淀,这说明Na2CO3溶液在与废液中的其它成分发生反应,根据形成废液的化学反应考虑;
(2)由图示可知,完全反应时生成沉淀的质量为5g,加入碳酸钠的质量为25g;和氯化钙溶液反应的碳酸钠的质量为25g-5g=20g.根据碳酸钠与氯化钙反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出与氯化钙反应的碳酸钠的质量,然后根据溶质质量分数的公式进行计算;
(3)根据题意(1)滤液中还含有溶质是HCl,与5克的碳酸钠溶液反应,根据反应的方程式,由碳酸钠的质量可求出还含有溶质的质量.
(2)由图示可知,完全反应时生成沉淀的质量为5g,加入碳酸钠的质量为25g;和氯化钙溶液反应的碳酸钠的质量为25g-5g=20g.根据碳酸钠与氯化钙反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出与氯化钙反应的碳酸钠的质量,然后根据溶质质量分数的公式进行计算;
(3)根据题意(1)滤液中还含有溶质是HCl,与5克的碳酸钠溶液反应,根据反应的方程式,由碳酸钠的质量可求出还含有溶质的质量.
解答:解:(1)因为废液是碳酸钙与盐酸反应后的废液,说明其中还有未完全反应的盐酸在与Na2CO3溶液反应;
(2)由题意可知,(25g-5g)Na2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀
设:20gNa2CO3溶液中溶质的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 5g
=
x=5.3g;
所以碳酸钠溶液溶质的质量分数=
×100%=26.5%
(3)5gNa2CO3溶液中碳酸钠的质量为:5g×26.5%=1.325g
设(1)滤液中还含有溶质的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
1.325g z
=
z=0.9g
故答为:(1)滤液中的溶质除含有CaCl2外,还含有HCl; (2)Na2CO3溶液中溶质的质量分数为26.5%;(3)题(1)滤液中还含有溶质的质量为0.9g.
(2)由题意可知,(25g-5g)Na2CO3溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀
设:20gNa2CO3溶液中溶质的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 5g
| 106 |
| 100 |
| x |
| 5g |
所以碳酸钠溶液溶质的质量分数=
| 5.3g |
| 20g |
(3)5gNa2CO3溶液中碳酸钠的质量为:5g×26.5%=1.325g
设(1)滤液中还含有溶质的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
1.325g z
| 106 |
| 73 |
| 1.325g |
| z |
故答为:(1)滤液中的溶质除含有CaCl2外,还含有HCl; (2)Na2CO3溶液中溶质的质量分数为26.5%;(3)题(1)滤液中还含有溶质的质量为0.9g.
点评:根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示.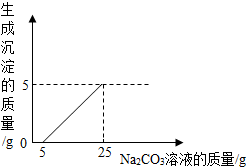 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示. 刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.