题目内容
【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中正确的是( )
A. 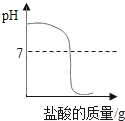 向一定量的氢氧化钠溶液中滴加稀盐酸直至过量
向一定量的氢氧化钠溶液中滴加稀盐酸直至过量
B. 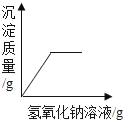 向一定量的硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液直至过量
向一定量的硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液直至过量
C. 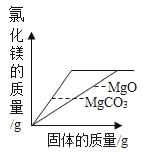 将足量碳酸镁和氧化镁固体分别加入相同质量、相同溶质质量分数的稀盐酸中
将足量碳酸镁和氧化镁固体分别加入相同质量、相同溶质质量分数的稀盐酸中
D. 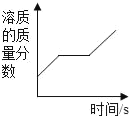 将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直至有少量晶体析出
将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直至有少量晶体析出
【答案】A
【解析】
A、氢氧化钠溶液呈碱性,故起初溶液的pH大于7,但随着稀盐酸的加入,会发生酸碱中和反应,使氢氧化钠逐渐减少,碱性渐弱,两者恰好完全反应时溶液呈中性,pH=7,继续加入稀盐酸,则酸过量,溶液显酸性,此选项正确;
B、加入氢氧化钠溶液后会发生两个反应,其中与硫酸铜溶液反应是有沉淀生成,但在溶液中有硫酸存在的条件下是不可能生成氢氧化铜沉淀的,所以先加的氢氧化钠溶液必须将硫酸完全反应后,才会与硫酸铜反应生成沉淀,也就是说这两个反应有先后顺序,图像的起点位置不能从原点开始,此选项错误;
C、生成等质量的氯化镁,实际参加反应的碳酸镁与氧化镁的质量比为84:40,即消耗固体的质量是碳酸镁大于氧化镁,图中给出的是消耗碳酸镁的质量小,此选项错误;
D、将一定质量的硝酸钾不饱和溶液恒温蒸发水分,溶质质量分数逐渐增大;至饱和后再蒸发水分,就会有少量晶体析出,此时溶液仍是该温度下的饱和溶液,溶质质量分数不变,此选项错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列装置,结合所学化学知识回答下列问题:

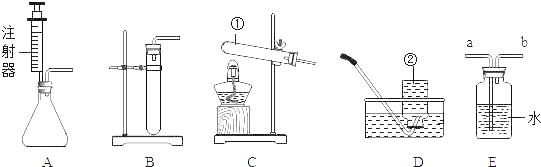
(1)写出图1中标号仪器的名称:①___。
(2)实验室用高锰酸钾制取氧气时,发生装置应选用___(填字母);其反应的化学方程式为___。如果改用氯酸钾和二氧化锰制取氧气,反应前后固体中二氧化锰的质量分数___(填“增大”、“减小”或“不变”)。
(3)实验室制取少量二氧化碳时,发生装置最好选用___(填字母,下同),收集装置选用___,常用此收集方法的原因是___,某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,可能的原因___
(4)CO2能与NaOH发生反应。
[实验过程]检查装置气密性,如图2所示连接好装置,进行实验。
序号 | 操作步骤 | 实验现象 |
Ⅰ | 打开弹簧夹K1,关闭弹簧夹K2、K3、K4.将20mL水注入锥形瓶I中,关闭弹簧夹K1,振荡瓶J,打开弹簧夹K2. | 无明显现象 |
Ⅱ | 关闭弹簧夹K2,打开弹簧夹K4,将20mL 稀NaOH溶液注入锥形瓶K中,关闭弹簧夹K4,振荡瓶J,打开弹簧夹K3. | 锥形瓶J中的热水剧烈沸腾 |
[实验分析]锥形瓶J的热水剧烈沸腾的原因是___。
[实验反思]有观点认为只需要进行实验操作Ⅱ,即可说明CO2与NaOH发生反应。你对该观点的看法是___(选填“赞同”或“不赞同”),理由是___。