题目内容
(2010?荆门)将氢氧化钾与氯化钾的固体混合物若干克溶于水配制成50g溶液,该溶液恰好与50.6g氯化镁溶液完全反应,过滤后得到94.8g滤液.已知滤液中溶质的质量分数为25%,求原固体混合物的质量.(已知:氢氧化钾能与氯化镁反应生成难溶于水的氢氧化镁.)
分析:据题意:氢氧化钾能与氯化镁反应生成难溶于水的氢氧化镁,氯化钾和氯化镁不反应;据质量守恒定律可知:生成的氢氧化镁的质量是:50g+50.6g-94.8g=5.8g,据生成氢氧化镁的质量结合方程式可计算出混合物中氢氧化钾的质量、生成的氯化钾的质量,并据滤液中溶质的质量分数可知氯化钾的总质量,氯化钾的总质量-生成的氯化钾的质量=混合物中氯化钾的质量,进而计算出混合物的总质量.
解答:解:据质量守恒定律可知:反应生成的氢氧化镁的质量是:50g+50.6g-94.8g=5.8g,
设混合物中KOH的质量为x,生成的氯化钾质量为y
2KOH+MgCl2═Mg(OH)2↓+2KCl
112 58 149
x 5.8g y
=
x=11.2g
=
y=14.9g
滤液中溶质KCl的质量为:94.8g×25%=23.7g;
原混合物中KCl的质量为:23.7g-14.9g=8.8g;
故原混合物的质量为:11.2g+8.8g=20g;
答:原混合物的质量为20g.
设混合物中KOH的质量为x,生成的氯化钾质量为y
2KOH+MgCl2═Mg(OH)2↓+2KCl
112 58 149
x 5.8g y
| 112 |
| x |
| 58 |
| 5.8g |
| 58 |
| 5.8g |
| 149 |
| y |
滤液中溶质KCl的质量为:94.8g×25%=23.7g;
原混合物中KCl的质量为:23.7g-14.9g=8.8g;
故原混合物的质量为:11.2g+8.8g=20g;
答:原混合物的质量为20g.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.必须认真分析题意,找出恰好完全反应时滤液中的溶质有哪些,才能正确答题.

练习册系列答案
相关题目
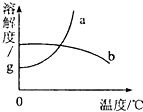 (2010?荆门)如图是a、b两种物质的溶解度曲线.室温时,将盛有a、b饱和溶液的试管分别放入烧杯内的水中,均无晶体析出.当向烧杯中加入NH4NO3固体或NaOH固体后,如图所示的试管内出现的现象正确的是( )
(2010?荆门)如图是a、b两种物质的溶解度曲线.室温时,将盛有a、b饱和溶液的试管分别放入烧杯内的水中,均无晶体析出.当向烧杯中加入NH4NO3固体或NaOH固体后,如图所示的试管内出现的现象正确的是( )
 小红:①⑤⑥⑨小明:④⑤⑧⑩
小红:①⑤⑥⑨小明:④⑤⑧⑩