题目内容
某省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成0.003mol二氧化碳.请计算:
(1)在盐酸中参加化学反应的HCl的物质的量.
(2)此加钙食盐中钙元素的质量分数.
解:设参加反应的HCl物质的量为x,食用碳酸钙的物质的量是z.
CaCO3+2HCl→CaCl2+H2O+CO2↑
1 2 1
z x 0.003mol
(1)则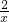 =
=
解得,x=0.006mol,
(2) =
= ,
,
z=0.003mol,
所以,m(CaCO3)=0.003moL×100g/mol=0.3g
m(Ca)=0.3g×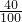 ×100%=0.12g
×100%=0.12g
此加钙食盐中钙元素的质量分数=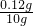 ×100%=1.2%;
×100%=1.2%;
答:(1)在盐酸中参加化学反应的HCl的物质的量是0.006mol.
(2)此加钙食盐中钙元素的质量分数是1.2%.
分析:根据碳酸钙与盐酸反应的化学方程式和生成的二氧化碳的摩尔数,即可计算出参与反应的盐酸、碳酸钙的物质的量;然后计算出钙元素的质量,根据“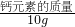 ×100%”计算出此加钙食盐中钙元素的质量分数.
×100%”计算出此加钙食盐中钙元素的质量分数.
点评:本题主要考查含杂质物质的化学方程式计算和质量分数的计算,难度较大.解题时要注意计算的步骤规范和计算的准确性.
CaCO3+2HCl→CaCl2+H2O+CO2↑
1 2 1
z x 0.003mol
(1)则
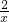 =
=
解得,x=0.006mol,
(2)
 =
= ,
,z=0.003mol,
所以,m(CaCO3)=0.003moL×100g/mol=0.3g
m(Ca)=0.3g×
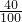 ×100%=0.12g
×100%=0.12g 此加钙食盐中钙元素的质量分数=
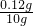 ×100%=1.2%;
×100%=1.2%;答:(1)在盐酸中参加化学反应的HCl的物质的量是0.006mol.
(2)此加钙食盐中钙元素的质量分数是1.2%.
分析:根据碳酸钙与盐酸反应的化学方程式和生成的二氧化碳的摩尔数,即可计算出参与反应的盐酸、碳酸钙的物质的量;然后计算出钙元素的质量,根据“
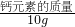 ×100%”计算出此加钙食盐中钙元素的质量分数.
×100%”计算出此加钙食盐中钙元素的质量分数.点评:本题主要考查含杂质物质的化学方程式计算和质量分数的计算,难度较大.解题时要注意计算的步骤规范和计算的准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目