题目内容
向45.8mL 密度为1.07g/cm3的硫酸溶液中,加入20g 溶质质量分数为20.8%的氯化钡溶液,充分反应后硫酸有剩余,再滴加20g20%的氢氧化钠溶液后,溶液呈中性.原硫酸溶液的溶质质量分数是 .
分析:在本题中,根据H2SO4+BaCl2=BaSO4↓+2HCl和H2SO4+2NaOH=Na2SO4+2H2O可知,氢离子和氢氧化钠溶液中的氢氧根离子恰好完全反应,然后再根据溶质的质量分数公式求硫酸溶质的质量分数;注意密度公式的应用.
解答:解:要求硫酸的质量分数就要知道硫酸的质量,根据硫酸中氢离子的质量就可以算出硫酸的质量,氢离子的物质的量与氢氧根的物质的量相等,氢氧化钠质量为20g×20%=4g,物质的量=
=0.1mol,所以氢氧根离子的物质的量也为0.1mol,则氢离子的物质的量为0.1mol,所以硫酸的物质的量为0.05mol,质量为0.05mol×98g/mol=4.9g,硫酸溶液质量为1.07g/mL×45.8mL=49g,溶液质量分数为
×100%=10%,故答案为:10%.
| 4g |
| 40g/mol |
| 4.9g |
| 49g |
点评:本考点考查了根据化学方程式的计算,属于结合课本知识的计算题,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要注意有关化学式的相对分子质量计算要正确,本考点主要出现在计算题中.

练习册系列答案
相关题目
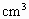 的硫酸溶液中,加入20g溶质的质量分数为20.8%氯化钡溶液,充分反应后硫酸有剩余,再滴加20g20%的氢氧化钠溶液后,溶液呈中性.原硫酸溶液溶质的质量分数为_______.
的硫酸溶液中,加入20g溶质的质量分数为20.8%氯化钡溶液,充分反应后硫酸有剩余,再滴加20g20%的氢氧化钠溶液后,溶液呈中性.原硫酸溶液溶质的质量分数为_______.