题目内容
(2008?天津)将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).(1)混合物中铜元素的质量分数为______(计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
【答案】分析:混合物与稀硫酸的质量和去掉所得溶液的质量,就是混合物中铜的质量;
进而可以计算出混合物中氧化铜的质量;
由氧化铜的质量可以计算出氧化铜中铜元素的质量;
由铜的质量、氧化铜中铜元素的质量和混合物的质量可以计算出混合物中铜元素的质量分数.
由氧化铜和稀硫酸的质量,根据氧化铜与稀硫酸反应的化学方程式可以计算出稀硫酸中溶质的质量分数.
解答:解:(1)混合物中铜的质量为
11.2g+100g-108g=3.2g
混合物中氧化铜的质量为
11.2g-3.2g=8g
氧化铜中铜元素的质量为
8g×(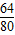 ×100%)=6.4g
×100%)=6.4g
混合物中铜元素的质量分数为
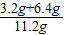 ×100%≈85.7%
×100%≈85.7%
(2)设稀硫酸中溶质的质量分数为x.
CuO+H2SO4=CuSO4+H2O
80 98
8g 100g×x
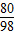 =
=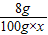 ,x=9.8%
,x=9.8%
答:(1)混合物中铜元素的质量分数为85.7%.
(2)稀硫酸中溶质的质量分数为9.8%.
点评:本题主要考查有关化学式的计算、含杂质物质的化学方程式计算,难度较大.
进而可以计算出混合物中氧化铜的质量;
由氧化铜的质量可以计算出氧化铜中铜元素的质量;
由铜的质量、氧化铜中铜元素的质量和混合物的质量可以计算出混合物中铜元素的质量分数.
由氧化铜和稀硫酸的质量,根据氧化铜与稀硫酸反应的化学方程式可以计算出稀硫酸中溶质的质量分数.
解答:解:(1)混合物中铜的质量为
11.2g+100g-108g=3.2g
混合物中氧化铜的质量为
11.2g-3.2g=8g
氧化铜中铜元素的质量为
8g×(
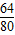 ×100%)=6.4g
×100%)=6.4g混合物中铜元素的质量分数为
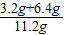 ×100%≈85.7%
×100%≈85.7%(2)设稀硫酸中溶质的质量分数为x.
CuO+H2SO4=CuSO4+H2O
80 98
8g 100g×x
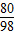 =
=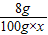 ,x=9.8%
,x=9.8%答:(1)混合物中铜元素的质量分数为85.7%.
(2)稀硫酸中溶质的质量分数为9.8%.
点评:本题主要考查有关化学式的计算、含杂质物质的化学方程式计算,难度较大.

练习册系列答案
相关题目