题目内容
【题目】下列图象,分别对应四个实验方案,其中能正确反映变化关系的是
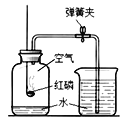
A.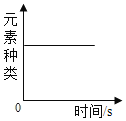 将一定质量的红磷在密闭容器中燃烧
将一定质量的红磷在密闭容器中燃烧
B.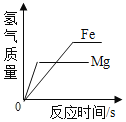 等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
C.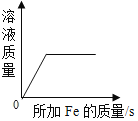 向一定质量的稀硫酸溶液中加入铁粉直至过量
向一定质量的稀硫酸溶液中加入铁粉直至过量
D.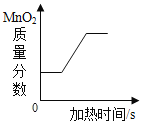 用加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气
用加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气
【答案】AD
【解析】
A、将一定质量的红磷在密闭容器中燃烧,红磷燃烧属于化学变化,遵循质量守恒定律,所以在燃烧前后元素的种类不变,正确;
B、等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中,则最终镁生成的氢气的质量大于铁,错误;
C、向一定质量的稀硫酸溶液中加入铁粉直至过量,开始溶液的质量不是0,错误;
D、加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气,开始不分解时二氧化锰的质量分数不变,当开始分解产生氧气,则固体的质量减小,二氧化锰的质量不变,质量分数开始变大,当完全反应固体质量不变,则质量分数不再改变,正确;
故选:AD。

 名校课堂系列答案
名校课堂系列答案【题目】某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 15 |
2 | 20 | 10 |
3 | 20 | 6.8 |
4 | 20 | 6.8 |
(1)四次实验中,第________次石灰石中碳酸钙有剩余,第____次实验中盐酸有剩余。
(2)样品中碳酸钙的质量分数是________。
(3)20g这种样品与足量稀盐酸反应后可产生二氧化碳的质量是多少________?(精确到0.1g)
【题目】兴趣小组围绕“实验室制取氧气”进行了一系列探究活动:
实验一 氧气制取实验
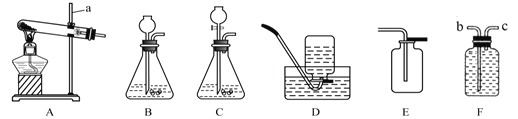
(1)现有如图装置
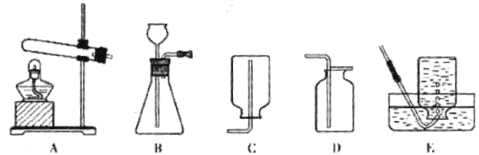
①药品选择:下列物质中不能作为制取氧气反应物的是_____(填标号),原因是_____
A 水
B 过氧化氢
C 氯化钾
D 高锰酸钾( KMnO4)
②实验室用高锰酸钾制取并收集较纯净氧气,应选择的发生装置和收集装置分别是_____(填标号, 下同)和_____。
③高锰酸钾制取氧气实验中出现了下列异常现象,请你分析其原因:
现象 | 原因 |
水槽中水呈紫红色 | Ⅰ:_____ |
水被倒吸沿导管进入试管中 | Ⅱ:_____ |
实验二 氯酸钾制取氧气
(2)取2g氯酸钾固体10份,分别加入不同质量的二氧化锰,加热反应,测得生成200mL氧气所用的时间,实验数据记录如下表:
实验編号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200mL氧气时间/秒 | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
①实验室加热氯酸钾和二氧化锰制取氧气的文字表达式_____
②分析上述数据,利用此法制取氧气,二氧化锰与氯酸钾的最佳质量比为_____
③当二氧化锰与氯酸钾的质量比高于最佳比时,反应速率变低的原因是_____(填标号)。
A 反应物含量过低,温度不易达到反应温度
B 催化剂与氯酸钾接触面积减小
C 二氧化锰不起催化作用
实验三 探究过氧化氢 制取氧气的适宜催化剂
(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、 Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如图装置进行实验。改用其他三种微球,分别重复上述实验,得到如图的锥形瓶内压强随时间变化的曲线图。
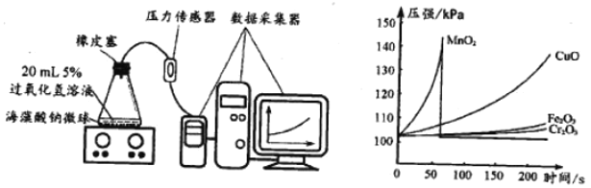
①每次实验时,海藻酸钠微球数应相同的原因_____
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_____
③从实验曲线看,催化效果较好、反应温和的催化剂是_____