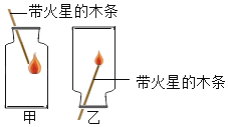
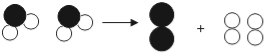
题目内容
【题目】工厂排放的废水中含有硫酸铜、硫酸亚铁和硫酸锌.同学们想从废水中回收硫酸锌和金属铜.设计了如下实验过程: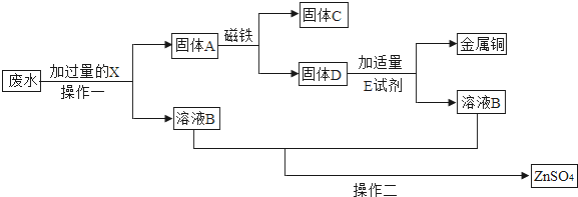
请回答下列问题:
(1)操作一的名称为________,操作二的名称为________.
(2)固体A中含有的物质是________,溶液B中的溶质是________.
(3)所加试剂E的名称为________.
(4)加试剂E发生反应的化学方程式为________.
【答案】过滤;蒸发锌、铁、铜(或Zn、Fe、Cu);硫酸锌或ZnSO4稀硫酸Zn+H2SO4=ZnSO4+H2↑
【解析】
(1)通过过滤可将固体与液体分离。通过蒸发可将溶质从溶液中结晶析出。(2)在金属活动性顺序中,排在前面的金属能把排在后面的金属从其化合物的水溶液中置换出来。要回收硫酸锌和金属铜,所以X是Zn,Zn +CuSO4=Cu+ ZnSO4 ,Zn +FeSO4 ==Fe+ ZnSO4 ,因为加入过量的X,所以固体A中含有的物质是生成的铜、铁以及过量的锌。溶液B中的溶质是硫酸锌。(3)铁能被磁铁吸引,固体D与E反应生成铜和硫酸锌,则固体C是铁,固体D是铜和锌的混合物,要回收硫酸锌和金属铜,所以E是稀硫酸。(4)金属活动性顺序中,由于铜位于氢的后面,不与稀硫酸反应,锌位于氢的前面,能与稀硫酸反应,所以向铜和锌的混合物中加入稀硫酸,反应的化学方程式为:Zn+ H2SO4 == ZnSO4 + H2↑

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】(1)用化学符号表示:
硫离子 ;②氨气分子 ;③氯化钠中钠的化合价 .
(2)水是宝贵的自然资源.请回答下列问题:
①下列净化水的方法中,净化程度最高的是_________(填序号)
A.吸附 | B.沉淀 | C.过滤 | D.蒸馏 |
②电解水实验中,与直流电源正极相连的玻璃管中生成的气体是_________,反应的化学方程式为 .
③生活中可用 的方法降低水的硬度;
写出生活中节约用水的一种做法:__________________.
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
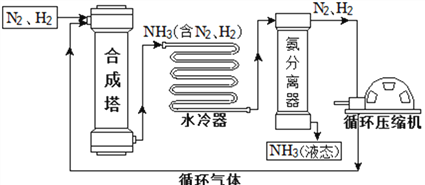
(1)合成塔中的反应必须在高温、高压、催化剂条件下进行,该反应的符号表达式是:__________________________________________________。
(2)生产过程中可重复使用的物质是_______________(填化学式)。
(3)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃(1.01×105 Pa) | –252 | –195.8 | –183 | –33.35 |
在1.01×105 Pa时,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在______℃。
(4)下图是合成塔中发生反应的微观粒子示意图:
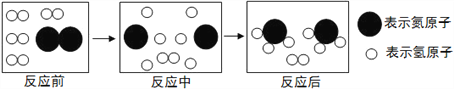
由图可知两种反应物N2与H2的分子个数比为____;该反应中的最小粒子是_________(填写化学符号)。