题目内容
【题目】我国科学家研发出由二氧化碳高效转化为甲醇(CH3OH)的新技术。
(1) 若该技术广泛应用,可把排放的CO2转化为甲醇,则能缓解______(填序号)。
A 酸雨 B 温室效应 C 白色污染
(2) 甲醇可被氧气氧化,其反应为:2CH3OH+O2 2X+2H2O,则X的化学式为______。
2X+2H2O,则X的化学式为______。
类比乙醇的燃烧,写出甲醇在空气中完全燃烧的化学方程式______。
(3) 若44gCO2全部转化为CH3OH,且反应中其它物质均不含碳元素,可生成CH3OH的质量为_____g。
【答案】B CH2O 2CH3OH+3O2![]() 2CO2+4H2O 32
2CO2+4H2O 32
【解析】
(1)二氧化碳大量排放到空气中会造成温室效应,若该技术广泛应用,可把排放的CO2转化为甲醇,会消耗大量的二氧化碳,能缓解温室效应,故应选B;
(2)在2CH3OH+O2 2X+2H2O中,反应物中:C的个数为2个,H的个数为8个,O的个数为4个;生成物中:H的个数为4个,O的个数为2个和2X,根据质量守恒定律,在化学反应中原子种类和数目不变可知,每个X中含有2个H、一个C、2个O, X的化学式为:CH2O;类比乙醇的燃烧,可知甲醇在空气中燃烧生成水和二氧化碳,化学方程式为:2CH3OH+3O2
2X+2H2O中,反应物中:C的个数为2个,H的个数为8个,O的个数为4个;生成物中:H的个数为4个,O的个数为2个和2X,根据质量守恒定律,在化学反应中原子种类和数目不变可知,每个X中含有2个H、一个C、2个O, X的化学式为:CH2O;类比乙醇的燃烧,可知甲醇在空气中燃烧生成水和二氧化碳,化学方程式为:2CH3OH+3O2![]() 2CO2+4H2O;
2CO2+4H2O;
(3)根据质量守恒定律可知,化学反应中元素质量不变。44gCO2全部转化为CH3OH,且反应中其它物质均不含碳元素,可生成CH3OH的质量![]() 。
。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行以下探究.
(猜想)
Ⅰ、氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ、氧化铜是反应的催化剂,反应前后____________ 。
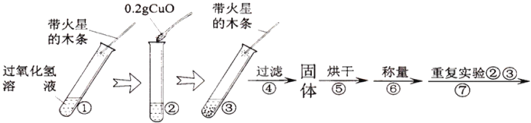
(实验)用天平称量0.2g氧化铜(CuO),取5mL5%的过氧化氢溶液于试管中,进行实验:
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
___________,带火星木条复燃。 | ___________ | 溶液中产生大量气泡,___________ 。 | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立. |
(2)步骤①的目的是______________。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学方程式为:___________