题目内容
下表列出了两种固体物质的溶解度,回答下列问题:| 温度 溶解度 |
0°C | 10 oC | 20 oC | 30 oC | 40 oC |
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g |
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
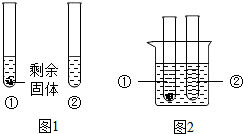
(2)10℃时,取A、B两种固体各3.5g,分别放入10g水中充分溶解,有如图1所示的实验现象,试管①中溶解的物质是
试管①
试管②
(3)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH固体相同的是
A.冰B.氯化钠C.生石灰D.硝酸铵.
(2)通过溶解度的大小,判断溶解后的现象,从而确定加入的物质;根据溶液状态饱和,选择恰当的计算公式;根据物质溶解时的吸热和放热现象,判断加入物质后溶液温度的变化情况,再根据溶解度受温度影响的变化趋势,分析出试管中出现的现象.
(3)与水混合放出热量的物质,都能达到与加入氢氧化钠固体相同效果.
(2)10℃时,A的溶解度大于B的溶解度,取A、B两种固体各3.5g,分别放入10g水中充分溶解,①中有剩余固体②中没有,说明①中加入的是B,②中加入的是A;①中的溶液饱和,用公式
| 溶解度 |
| 100+溶解度 |
(3)A加冰后使溶液降温,所以错误;B加入氯化钠,溶液的温度无明显变化,所以错误;C加入生石灰,它和水反应生成熟石灰,反应是放热反应,所以正确;D加入硝酸铵,它溶解于水吸热,使溶液温度降低,所以错误.
故答案为:(1)降低温度、加入硝酸钾、蒸发水或溶剂(答出任一点得分).
(2)B;17.3%;
①试管中固体逐渐减少以至消失;②试管中有固体析出.
(3)C.

下表列出了两种固体物质的溶解度,回答下列问题:
|


|
0oC |
10 oC |
20 oC |
30 oC |
40 oC |
||||||||||||||
|
A |
37.4g |
36.0g |
34.7 g |
33.8 g |
33.2 g |
||||||||||||||
|
B |
13.3 g |
20.9 g |
31.6 g |
45.8 g |
63.9 g |
(1)10℃时,取A、B两种固体各3.5g,分别放入10g水中充分溶解,有如图1所示的实验现象,

试管①中溶解的物质是 (填“A”或“B”),其溶液中溶质的质量分数为 (精确到0.1%)。将两只试管同时放入盛有水的烧杯中(如图2),
向烧杯中加入足量NaOH固体并轻轻搅拌,观察到两个试管中的现象分别是:
试管① ;
试管② 。
(2)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH固体相同是 。
A.冰 B.氯化钠 C.生石灰 D.硝酸铵
下表列出了两种固体物质的溶解度,回答下列问题:
|
| 0oC | 10 oC | 20 oC | 30 oC | 40 oC | ||||||||||||||
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g | ||||||||||||||
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
(1)B为硝酸钾,硝酸钾溶液中的溶剂是 。
(2)将硝酸钾的不饱和溶液变为饱和溶液的方法有 。
(3)10 oC时,取A、B两种固体各35g,分别放入100g水中充分溶解,有如图所示的实验现象,
试管①中溶解的物质是 (填“A”或“B”),其溶液中溶质的质量分数为 (保留一位小数),将两只试管分别放入盛有水的烧杯中(图2),向烧杯中加入足量NaOH并轻轻搅拌,观察到
。
(4)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH不同的是
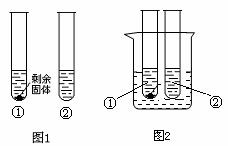 A.冰 B.干冰 C.生石灰 D.硝酸铵
A.冰 B.干冰 C.生石灰 D.硝酸铵
下表列出了两种固体物质的溶解度,回答下列问题:
|

| 0oC | 10 | 20 oC | 30 oC | 40 oC | ||||||||||||||
| A | 37.4g | 36.0g | 34.7 g | 33.8 g | 33.2 g | ||||||||||||||
| B | 13.3 g | 20.9 g | 31.6 g | 45.8 g | 63.9 g |
(1)10℃时,取A、B两种固体各3.5g,分别放入10g水
中充分溶解,有如图1所示的实验现象,试管①中溶解的
物质是 (填“A”或“B”),其溶液中溶质的质
量分数为 (精确到0.1%)。将两只试管同时放入盛有水的烧杯中(如图2),
向烧杯中加入足量NaOH固体并轻轻搅拌,观察到两个试管中的现象分别是:
试管① ![]()
![]() ;
;
试管② 。
(2)若向烧杯中加入适量下列物质,两试管中的现象与加NaOH固体相同是 。
A.冰 B.氯化钠 C.生石灰 ![]()
![]() D.硝酸铵
D.硝酸铵
