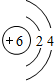题目内容
 (2011?广西)如图所示,铁丝在试管内长时间放置,铁丝表面有红棕色物质出现,水面上升约占原试管内空气体积的
(2011?广西)如图所示,铁丝在试管内长时间放置,铁丝表面有红棕色物质出现,水面上升约占原试管内空气体积的1/5
1/5
.该红棕色物质的主要成分与稀盐酸反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
.分析:空气中的氧气约占空气总体积的五分之一,铁锈的主要成分是氧化铁,氧化铁能和稀盐酸反应,生成氯化铁和水.
解答:解:铁丝在试管内长时间放置时,铁丝与试管中的水和氧气反应生成铁锈,试管中的氧气被消耗完后,空气体积大约减少五分之一,从而使水面上升,水面上升约占原试管内空气体积的五分之一.
故填:1/5.
氧化铁能和稀盐酸反应,生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O.
故填:Fe2O3+6HCl=2FeCl3+3H2O.
故填:1/5.
氧化铁能和稀盐酸反应,生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O.
故填:Fe2O3+6HCl=2FeCl3+3H2O.
点评:书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.

练习册系列答案
相关题目
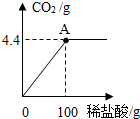 (2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:
(2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算: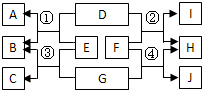 (2011?广西)A、B、C、D、E、F、G、H均为初中化学学习中常见的物质,其转化关系如图所示(反应条件已省略).其中E、G为黑色粉末,H为最常用的液态溶剂,I的溶液呈黄色,J的溶液呈蓝色.
(2011?广西)A、B、C、D、E、F、G、H均为初中化学学习中常见的物质,其转化关系如图所示(反应条件已省略).其中E、G为黑色粉末,H为最常用的液态溶剂,I的溶液呈黄色,J的溶液呈蓝色.