题目内容
(2012?眉山)下列图象中有关量的变化趋势与对应叙述关系正确的是( )
分析:A、依据硫酸稀释时pH的变化分析判断;
B、依据气体的溶解度随温度升高而降低进行分析判断;
C、依据镁铁金属的活动性依据生成氢气的量分析判断;
D、依据浓盐酸的挥发性分析判断;
B、依据气体的溶解度随温度升高而降低进行分析判断;
C、依据镁铁金属的活动性依据生成氢气的量分析判断;
D、依据浓盐酸的挥发性分析判断;
解答:解:A、硫酸稀释时其酸性会不断减弱,pH变大但不会大于7,故图象错误;
B、气体的溶解度随温度升高而降低,氧气也不例外,所以随温度的升高氧气的溶解度会减小,故图象错误;
C、镁的金属活动性比铁强,所以与相同浓度的盐酸反应时反应速度镁比铁快,且同质量的镁铁与酸反应生成氢气的量是镁大于铁,分析该图象可知该图象能反映以上情况;
D、浓盐酸具有挥发性所以浓盐酸会不断挥发出氯化氢气体而使溶液的质量不断变小,但溶液的质量不会是零,故图象错误;
故选C
B、气体的溶解度随温度升高而降低,氧气也不例外,所以随温度的升高氧气的溶解度会减小,故图象错误;
C、镁的金属活动性比铁强,所以与相同浓度的盐酸反应时反应速度镁比铁快,且同质量的镁铁与酸反应生成氢气的量是镁大于铁,分析该图象可知该图象能反映以上情况;
D、浓盐酸具有挥发性所以浓盐酸会不断挥发出氯化氢气体而使溶液的质量不断变小,但溶液的质量不会是零,故图象错误;
故选C
点评:考查解答该题的关键是关注实验的过程,在分析实验过程的同时,加强读图能力的提升,具有较强的综合性.

练习册系列答案
相关题目
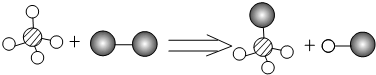


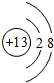 表示的是
表示的是