题目内容
【题目】(2分)【资料获悉】铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu
Fe2O3+3Cu
铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2
一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙.下列判断正确的是( )
①甲中不含FeCl3;
②甲中含有FeCl3;
③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;
④若向固体丙加稀盐酸有气体产生,则滤液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2.
A.①③ B.②③ C.①④ D.②④
【答案】A
【解析】铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu;铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2↑可以建立以下关系式:
Fe2O3+3Cu;铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2以及Fe2O3+6HCl=2FeCl3+3H2↑可以建立以下关系式:
Fe2O3~2FeCl3~Cu根据铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu可知生成物质氧化铁铁和铜的个数比是1:3,因此氯化铁一定能完全被铜反应,所以甲中不含FeCl3;所以溶液中存在FeCl2和CuCl2,由于相关金属的活动性顺序是锌>铁>铜,所以放入锌粒后锌首先置换出铜,所以固体若向固体丙加稀盐酸无明显现象,说明固体不是铁和锌,所以滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固体丙加稀盐酸有气体产生,说明固体可能是锌或铁,因此溶液中不可能含有CuCl2,一定含有ZnCl2可能含有FeCl2,综上所述①③正确;
Fe2O3+3Cu可知生成物质氧化铁铁和铜的个数比是1:3,因此氯化铁一定能完全被铜反应,所以甲中不含FeCl3;所以溶液中存在FeCl2和CuCl2,由于相关金属的活动性顺序是锌>铁>铜,所以放入锌粒后锌首先置换出铜,所以固体若向固体丙加稀盐酸无明显现象,说明固体不是铁和锌,所以滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2,若向固体丙加稀盐酸有气体产生,说明固体可能是锌或铁,因此溶液中不可能含有CuCl2,一定含有ZnCl2可能含有FeCl2,综上所述①③正确;
故选A

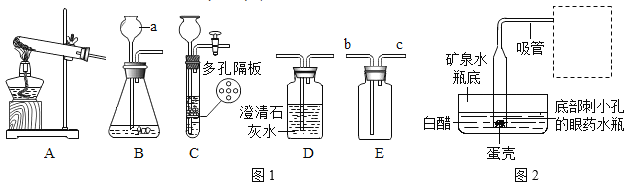
【题目】铁与水蒸气在高温条件下反应生成了一种铁的氧化物和一种气体单质,实验装罝如下图所示。
(1)试管尾部放一团湿棉花的目的是__________。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空气中。说明生成的气体是__________。
(3)探宄试管中剩余固体的成分。
(査阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色品体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:
Fe304+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余间体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物__________、__________。
(猜想与假设)
猜想一:剩余固体是Fe304;
猜想二:剩余固体是__________。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____________。 | 猜想一不成立, 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为____________________。
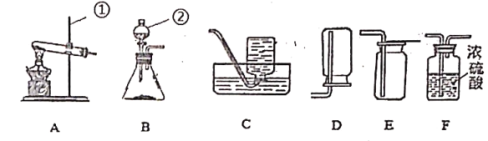
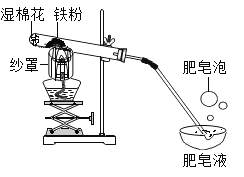
【题目】现有下列仪器或装置,请回答下列问题:
①仪器a的名称是______:用______![]() 填仪器名称
填仪器名称![]() 取废铁屑放入试管,可以用图A~E仪器组装成制取气体的发生装置:用废铁屑与稀盐酸反应制取H2,应选______
取废铁屑放入试管,可以用图A~E仪器组装成制取气体的发生装置:用废铁屑与稀盐酸反应制取H2,应选______![]() 填字母
填字母![]() ,写出反应的化学方程式:______。
,写出反应的化学方程式:______。
②选择气体收集方法时,必须考虑的气体性质有______![]() 填序号
填序号![]() 。
。
A 颜色 B 密度 C 溶解性 D 可燃性
③向“人”字型管G装置![]() 端分别装入一种固体和一种液体物质,按图示连接好装置,再倾斜装置,使乙中液体流入甲中。填写下表。
端分别装入一种固体和一种液体物质,按图示连接好装置,再倾斜装置,使乙中液体流入甲中。填写下表。
操作及现象 | 所装固体物质和液体物质 | 两端物质反应的化学方程式 |
将带火星木条放在试管口,木条复燃 | ______ | ______ |
将燃着木条放在试管口,木条熄灭 | ______ | ______ |
④若要检验F装置中产生的气体中是否含有水蒸气,干燥管中应该装入的物质是______。
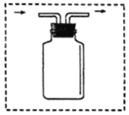
⑤若用如图装置且正放在桌上进行“排空气法”收集制取的H2,请把图中的“导气管”补画完整_____。
【题目】等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t内产生气体体积V的数据,根据数据绘制得到图1。
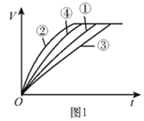
组别 | 盐酸的溶质质量分数/% | 温度/℃ |
① | 7 | 30 |
② | 10 | 50 |
③ | 7 | 20 |
④ | 10 | 30 |
(1)请写出铁粉与稀盐酸反应的化学方程式:________。
(2)通过实验①③对比,得出的结论是________;要比较盐酸的溶质质量分数对反应快慢的影响,应选择的实验组别是________。
(3)实验中产生气体“逐渐变快又变慢”的原因是________。
(进一步探究)图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与20 mL 10%的稀盐酸反应产生氢气的量(产生氢气的量由气体压强表示,在等温条件下,产生氢气的体积与装置内压强成正比)。
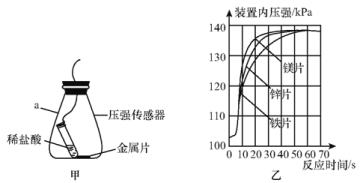
①实验中你认为还要控制的变量是________。
②根据图乙,你得出的反应物的量与生成的气体体积的关系是________。
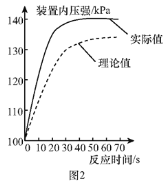
(拓展提高)图2为测得的室温下足量的镁片与20 mL 10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点):
①________;②________。