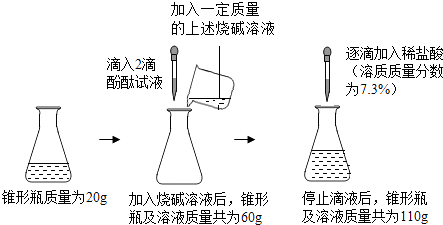
题目内容
【题目】氯化钠和氧化镁是重要的化工原料,某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案: 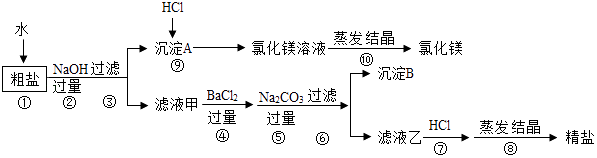
请回答下列问题:
(1)步骤④⑤的顺序颠倒会引发的后果是 .
(2)滤液乙中所含的溶质除氯化钠外还含有 .
(3)沉淀B中除含碳酸钙、碳酸钡外还含有 .
【答案】
(1)精盐中会混有氯化钡
(2)碳酸钠和氢氧化钠
(3)硫酸钡
【解析】解:正确的操作步骤为:①将粗盐溶于足量水中制成溶液;②向溶液中加入足量的NaOH溶液,除去Mg2+ , 反应的方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,过滤,除去滤渣;③向上述溶液中加入足量的BaCl2溶液,除去SO42﹣ , 反应的化学方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;④向上述滤液中加入足量的Na2CO3溶液,除去Ca2+、Ba2+ , 反应的方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl;⑤向(4)滤液中滴加稀盐酸,调节PH=7,除去CO32﹣和OH﹣ , 反应的化学方程式为:Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O;⑥将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐; 其中加入氢氧化钠的顺序中,只要放在过滤之前即可,加入碳酸钠溶液必须放在加入氯化钡溶液之后,否则多余的钡离子无法除去,(1)氯化钡除SO42﹣ , 碳酸钠除Ca2+和前面过量的钡离子;加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去;,精盐中会混有氯化钡;(2)根据上述除杂过程可知,滤液乙中所含的溶质除氯化钠外还含有碳酸钠和氢氧化钠;Ⅲ.(3)由于硫酸钠能与氯化钡生成了硫酸钡沉淀,加入的碳酸钠能与氯化钙反应生成了碳酸钙沉淀、与过量的氯化钡生成了碳酸钡沉淀,所以.沉淀B中除含碳酸钙、碳酸钡外还含有硫酸钡.
所以答案是:(1)精盐中会混有氯化钡;(2)碳酸钠和氢氧化钠;(3)硫酸钡.

 阅读快车系列答案
阅读快车系列答案