题目内容
【题目】(11分)某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一瓶溶液的试剂瓶未盖瓶盖且标签破损,于是决定利用现有药品对这瓶溶液进行实验探究:
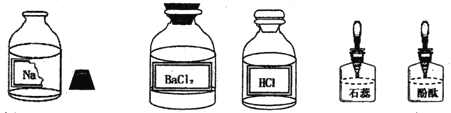
【提出问题】这瓶溶液是什么溶液?
【获得信息】1.性质实验中用到含用钠元素的物质是氢氧化钠、碳酸钠和硫酸钠
2.硫酸钠溶液、氯化钡溶液都呈中性
【提出问题】这瓶溶液是:
猜想①: ;
猜想②:氢氧化钠溶液;
猜想③:碳酸钠溶液;
【实验探究】
(1)小丽取样滴加 溶液,溶液呈红色,得出结论:猜想 不成立。理由是 。
(2)小刚另取样品滴加BaCl2溶液,有 产生,小刚得出结论:猜想②不成立。小组同学讨论后认为结论不正确,理由是 。
小组同学讨论后一致认为应如下进行实验:
【继续探究】
(3)取样品加入过量的BaCl2溶液,加“过量”的目的是 ;静置后,取上层清液滴入酚酞试液,溶液呈红色。在剩余物质中滴入足量的稀盐酸,固体全部溶解,固体溶解的反应的化学方程式是 。
【实验结论】
(4)这瓶溶液是 。
【探究启示】
(5)实验取完药品后应 。
【答案】【提出问题】Na2SO4溶液
(1)酚酞 ① Na2SO4溶液呈中性,不能使酚酞变色
(2)白色沉淀 NaOH变质生成Na2CO3,也能与BaCl2反应生成沉淀
(3)除尽Na2CO3 BaCO3+2HCl=BaCl2+H2O+CO2↑
(4)变质的NaOH溶液(或NaOH与Na2O3的混合液)
(5)密封保存
【解析】
试题分析:【提出问题】根据破损标签上残留字样,以及获得的信息,可猜想①:Na2SO4溶液
(1)溶液呈红色,说明小丽滴加的是无色酚酞溶液;故可得出结论:猜想①不成立,理由是:Na2SO4溶液呈中性,不能使酚酞变色
(2)另取样品滴加BaCl2溶液,有白色沉淀产生,小刚得出结论:猜想②不成立。小组同学讨论后认为结论不正确,理由是:NaOH变质生成Na2CO3,也能与BaCl2反应生成沉淀
(3)取样品加入过量的BaCl2溶液,加“过量”的目的是除尽Na2CO3;发生的反应:BaCl2+Na2CO3==BaCO3↓+2NaCl;静置后,取上层清液滴入酚酞试液,溶液呈红色。在剩余物质中滴入足量的稀盐酸,固体全部溶解,固体溶解的反应的化学方程式是BaCO3+2HCl=BaCl2+H2O+CO2↑
(4)通过上面的探究,这瓶溶液是变质的NaOH溶液(或NaOH与Na2O3的混合液)
(5)实验取完药品后应密封保存,以免变质