题目内容
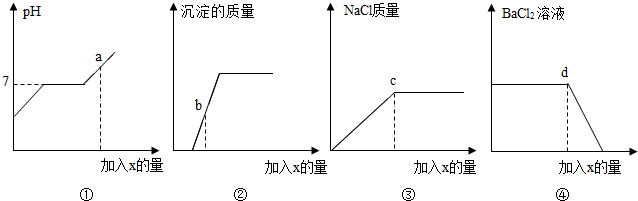
小红同学向盐酸与氯化钡的混合溶液中逐滴滴入碳酸钠溶液至过量.记录滴入的碳酸钠溶液的质量(x)与有关量的变化关系如图所示.下列判断正确的是( )
A.①图中,当碳酸钠溶液加至a点时,溶液中Na2CO3正与BaCl2发生反应
B.②图中,当碳酸钠溶液加至b点时,所得溶液的pH=7
C.③图中,当碳酸钠溶液加至c点时,溶液中含有的溶质是氯化钠和氯化钡
D.④图中,当碳酸钠溶液加至d点时,溶液中BaCl2与Na2CO3恰好反应完全
【答案】分析:向盐酸与氯化钡的混合溶液中逐滴滴入碳酸钠溶液至过量,①碳酸钠先与混合溶液中稀盐酸反应生成氯化钠、水和二氧化碳,而使溶液pH及氯化钠的质量逐渐增大;②待盐酸恰好完全反应,溶液pH等于7,碳酸钠开始与氯化钡反应生成碳酸钡沉淀和氯化钠,溶液pH不变而沉淀碳酸钡质量、氯化钠质量不断增加直至反应结束;③待氯化钡完全反应,沉淀碳酸钡及氯化钠的质量不再改变.
解答:解:A、由以上分析可知①图中a点为碳酸钠与氯化钡完全反应后继续滴加碳酸钠的过程,碳酸钠溶液呈碱性,所以会导致溶液的pH在此时大于7;故A错误;
B、②图中b点为盐酸和碳酸钠完全反应后进行氯化钡和碳酸钠反应生成沉淀情况,由于沉淀没有达到最大值,所以此时溶液中既无盐酸有没有剩余的碳酸钠,只含有氯化钠和氯化钡,所以此时的溶液pH=7;故B正确;
C、③图中c点为氯化钠的最大值,由与碳酸钠和盐酸,氯化钡和碳酸钠均能反应生成氯化钠,所以当氯化钠为最大值时,溶液中的盐酸和氯化钡一定完全参与了反应,故C错误.
D、图④中的d点时氯化钡质量开始减小的点,所以此时是盐酸和碳酸钠刚好完全反应,而碳酸钠和氯化钡也恰好开始反应的点,故D错误;
故选B.
点评:做此题型时,一定要认真审题,文字叙述与图象相结合,还要联系和应用课本中学过的有关的知识点,综合分析,问题就会迎刃而解.
解答:解:A、由以上分析可知①图中a点为碳酸钠与氯化钡完全反应后继续滴加碳酸钠的过程,碳酸钠溶液呈碱性,所以会导致溶液的pH在此时大于7;故A错误;
B、②图中b点为盐酸和碳酸钠完全反应后进行氯化钡和碳酸钠反应生成沉淀情况,由于沉淀没有达到最大值,所以此时溶液中既无盐酸有没有剩余的碳酸钠,只含有氯化钠和氯化钡,所以此时的溶液pH=7;故B正确;
C、③图中c点为氯化钠的最大值,由与碳酸钠和盐酸,氯化钡和碳酸钠均能反应生成氯化钠,所以当氯化钠为最大值时,溶液中的盐酸和氯化钡一定完全参与了反应,故C错误.
D、图④中的d点时氯化钡质量开始减小的点,所以此时是盐酸和碳酸钠刚好完全反应,而碳酸钠和氯化钡也恰好开始反应的点,故D错误;
故选B.
点评:做此题型时,一定要认真审题,文字叙述与图象相结合,还要联系和应用课本中学过的有关的知识点,综合分析,问题就会迎刃而解.

练习册系列答案
相关题目