题目内容
请你参与某校学习小组进行的以下研究性学习的过程,并协助完成相关任务.【研究课题】探究热水壶底部水垢的主要成分
【查阅资料】该小组同学通过查阅资料知道:
①天然水中一般都含有Ca2+、Mg2+、
 等离子.
等离子.②在加热条件下,这些离子趋于生成溶解度更小的物质,即水垢.(主要成分为碳酸盐、碱等物质的混合物).
③碱石灰的化学成分是CaO与NaOH的混合物,可吸收水分和酸性气体(如二氧化碳).
④有关物质的溶解性如下:
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入______,没有白色沉淀产生,说明水垢中无Ca(OH)2.
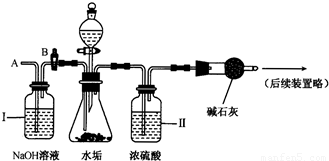
(2)乙同学设计了下列实验装置,进一步确定水垢中是否含有碳酸盐的成分.其主要实验步骤如下:
①按下图组装仪器,检查装置气密性,再将50g水垢试样放入锥形瓶中,并加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量;
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓放入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变,并称得干燥管质量增加了24g.
讨论:
a.步骤①所加的酸溶液是______.
b.从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是______.
c.研究性学习小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是______.
【实验结论】通过上述探究可知:水垢的主要成分有______.
【答案】分析:根据物质的溶解性考虑沉淀一定含有的成分和可能含有的成分;根据能与氢氧化钙反应产生沉淀考虑需要的物质是碳酸盐;根据硫酸(盐酸)与碳酸钙反应的现象不同考虑;本题测定碳酸盐主要是通过碳酸盐与酸反应产生二氧化碳来测定,最后装置内有二氧化碳,要通过空气将二氧化碳排到装置的右端要考虑空气中二氧化碳的影响,根据碳酸钙与盐酸反应生成二氧化碳的质量与碳酸镁与盐酸反应生成二氧化碳的质量大小判断是否含有碳酸镁.
解答:解:水垢属于沉淀下来的物质,所以不溶物质一定有,微溶物质可能有;根据加入试剂后没有白色沉淀产生,说明水垢中无Ca(OH)2,说明该试剂能与氢氧化钙反应产生沉淀,所以属于可溶性碳酸盐,可以是碳酸钠;由于硫酸与碳酸钙反应生成的硫酸钙微溶于水,反应会停止,所以步骤①所加的酸溶液是稀盐酸;本题测定碳酸盐主要是通过碳酸盐与酸反应产生二氧化碳来测定,最后装置内有二氧化碳,要通过空气将二氧化碳排到装置的右端,为了排除空气中二氧化碳的干扰,必须通过一种试剂将空气中二氧化碳吸收;根据直至干燥管内物质质量不变,并称得干燥管质量增加了24g,说明生成二氧化碳24g,假设50 g水垢全部为CaCO3,则产生CO2的质量应为22 g,所以水垢中一定含有碳酸镁;根据开始知道一定含有Mg(OH)2、CaCO3,又根据计算还存在碳酸镁,所以成分为Mg(OH)2、CaCO3、MgCO3.
故答案为:【提出猜想】CaCO3MgCO3
【设计方案】(1)Na2CO3溶液 (2)a.稀盐酸 b.除去空气中的CO2c.假设50 g水垢全部为CaCO3,则产生CO2的质量应为22 g,而实验测得生成的CO2质量>22 g
【实验结论】Mg(OH)2、CaCO3、MgCO3
点评:通过回答本题知道了水垢的主要成分有Mg(OH)2、CaCO3、MgCO3,在除水垢时用酸来除,一般用醋来除水垢.
解答:解:水垢属于沉淀下来的物质,所以不溶物质一定有,微溶物质可能有;根据加入试剂后没有白色沉淀产生,说明水垢中无Ca(OH)2,说明该试剂能与氢氧化钙反应产生沉淀,所以属于可溶性碳酸盐,可以是碳酸钠;由于硫酸与碳酸钙反应生成的硫酸钙微溶于水,反应会停止,所以步骤①所加的酸溶液是稀盐酸;本题测定碳酸盐主要是通过碳酸盐与酸反应产生二氧化碳来测定,最后装置内有二氧化碳,要通过空气将二氧化碳排到装置的右端,为了排除空气中二氧化碳的干扰,必须通过一种试剂将空气中二氧化碳吸收;根据直至干燥管内物质质量不变,并称得干燥管质量增加了24g,说明生成二氧化碳24g,假设50 g水垢全部为CaCO3,则产生CO2的质量应为22 g,所以水垢中一定含有碳酸镁;根据开始知道一定含有Mg(OH)2、CaCO3,又根据计算还存在碳酸镁,所以成分为Mg(OH)2、CaCO3、MgCO3.
故答案为:【提出猜想】CaCO3MgCO3
【设计方案】(1)Na2CO3溶液 (2)a.稀盐酸 b.除去空气中的CO2c.假设50 g水垢全部为CaCO3,则产生CO2的质量应为22 g,而实验测得生成的CO2质量>22 g
【实验结论】Mg(OH)2、CaCO3、MgCO3
点评:通过回答本题知道了水垢的主要成分有Mg(OH)2、CaCO3、MgCO3,在除水垢时用酸来除,一般用醋来除水垢.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
请你参与某校学习小组进行的以下研究性学习的过程,并协助完成相关任务.
【研究课题】探究热水壶底部水垢的主要成分
【查阅资料】该小组同学通过查阅资料知道:
①天然水中一般都含有Ca2+、Mg2+、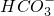 等离子.
等离子.
②在加热条件下,这些离子趋于生成溶解度更小的物质,即水垢.(主要成分为碳酸盐、碱等物质的混合物).
③碱石灰的化学成分是CaO与NaOH的混合物,可吸收水分和酸性气体(如二氧化碳).
④有关物质的溶解性如下:
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入______,没有白色沉淀产生,说明水垢中无Ca(OH)2.
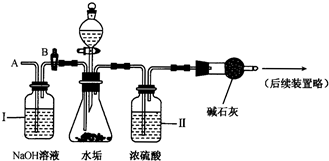
(2)乙同学设计了下列实验装置,进一步确定水垢中是否含有碳酸盐的成分.其主要实验步骤如下:
①按下图组装仪器,检查装置气密性,再将50g水垢试样放入锥形瓶中,并加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量;
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓放入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变,并称得干燥管质量增加了24g.

讨论:
a.步骤①所加的酸溶液是______.
b.从导管A处缓缓鼓入一定量的空气时,装置Ⅰ的作用是______.
c.研究性学习小组的同学通过简单计算,认为水垢中一定含有MgCO3,理由是______.
【实验结论】通过上述探究可知:水垢的主要成分有______.
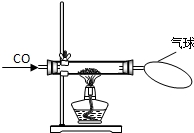 某校化学研究性学习小组的同学在学习了金属与酸的相关知识后,做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
某校化学研究性学习小组的同学在学习了金属与酸的相关知识后,做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务: