题目内容
 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液究竟是什么溶液?
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液究竟是什么溶液?【提出猜想】王老师提示:这瓶无色溶液只能是下面四种溶液中的一种:
①硫酸镁溶液②硫酸钠溶液③硫酸溶液④硫酸铵溶液
【查阅资料】(1)常温下,相关物质的溶解度如下:
| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水以任意比互溶 |
(3)含NH4+的盐与碱混合受热,会放出NH3
【实验探究】(1)通过查阅资料,小明同学认为猜想②不成立,原因是
常温下Na2SO4溶液的溶质质量分数不可能达到20%
常温下Na2SO4溶液的溶质质量分数不可能达到20%
.(2)为确定其他几种猜想是否正确,小明同学继续进行探究:
| 实验操作 | 实验现象 | 实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 NaOH NaOH 溶液 |
溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,和比色卡对照 | 溶液的pH小于7 | 猜想③成立 |
(NH4)2SO4溶液也呈酸性
(NH4)2SO4溶液也呈酸性
.(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少许于试管中, 加入少量的NaOH溶液,然后将湿润的红色石蕊试纸放在试管口 加入少量的NaOH溶液,然后将湿润的红色石蕊试纸放在试管口 |
有刺激性气味的气体产生,红色石蕊试纸变蓝 有刺激性气味的气体产生,红色石蕊试纸变蓝 |
猜想④成立,该反应的化学方程式 (NH4)2SO4+2NaOH= Na2SO4+2NH3↑+2H2O (NH4)2SO4+2NaOH= Na2SO4+2NH3↑+2H2O |
硫酸铵的制备:工业上用硫铁矿(主要成分是FeS2),经过沸腾焙烧炉内通空气燃烧生成SO2和Fe2O3,SO2经催化剂和氧气的共同作用在接触室内转化为SO3,最后SO3在吸收塔内和水的共同作用转化为H2SO4.实验室就是用制得H2SO4溶液中通NH3相互化合制得一瓶上述132g20%(NH4)2SO4溶液.(反应中不考虑物质的损耗)思考:①在工业上要把硫铁矿先碾成粉末再反应的原因是
增大硫铁矿与空气的接触面积
增大硫铁矿与空气的接触面积
.②要制得132g20%(NH4)2SO4溶液,需含40% FeS2的硫铁矿的质量是30
30
g.分析:【实验探究】(1)根据溶解度与饱和溶液的质量分数的关系,利用饱和溶液的溶质质量分数为该温度下该溶液的溶质质量分数最大值,由硫酸钠的溶解度为19.5g而标签上标明溶液的溶质质量分数为20.0%,可判断猜想②溶液为硫酸钠溶液是不成立的;
(2)通过滴加某试剂观察到出现白色沉淀而判断溶液为硫酸镁,根据三种溶液中溶质化学性质的差异,可判断所滴加溶液应为碱溶液如氢氧化钠溶液;根据硫酸溶液和硫酸铵溶液都呈酸性的特点,可判断由pH小于7就得出溶液为硫酸溶液的说法不能成立;
(3)根据硫酸铵溶液中含有铵根的特殊性,可通过检验铵根的存在而确认溶液为硫酸铵;
(4)根据促进燃烧的方法分析;根据硫元素守恒,利用关系式列式计算,反应的关系式为:FeS2~(NH4)2SO4进行计算.
(2)通过滴加某试剂观察到出现白色沉淀而判断溶液为硫酸镁,根据三种溶液中溶质化学性质的差异,可判断所滴加溶液应为碱溶液如氢氧化钠溶液;根据硫酸溶液和硫酸铵溶液都呈酸性的特点,可判断由pH小于7就得出溶液为硫酸溶液的说法不能成立;
(3)根据硫酸铵溶液中含有铵根的特殊性,可通过检验铵根的存在而确认溶液为硫酸铵;
(4)根据促进燃烧的方法分析;根据硫元素守恒,利用关系式列式计算,反应的关系式为:FeS2~(NH4)2SO4进行计算.
解答:解:【实验探究】(1)某温度下饱和溶液的溶质质量分数的值不会大于该温度下溶质的溶解度,常温下硫酸钠的溶解度为19.5g,则常温下它的饱和溶液的溶质的质量分数=
×100%<20.0%,因此,该溶液不可能是硫酸钠,故猜想②不成立;
(2)硫酸镁、硫酸、硫酸铵三种物质中只有硫酸镁能与碱溶液氢氧化钠溶液形成氢氧化镁沉淀,因此,观察到出现白色沉淀就可判断溶液为硫酸镁溶液,说明所使用的试剂为氢氧化钠溶液;由于硫酸溶液、硫酸铵溶液都呈酸性的原因,测出溶液的pH小于7时,并不能就断定溶液为硫酸溶液,也可能是硫酸铵溶液;
(3)只要检验出溶液中含有铵根离子即可说明溶液为硫酸铵,因此可取溶液加入少量氢氧化钠溶液,然后在试管口放一张湿润的红色石蕊试纸,观察到有刺激性气味气体产生、试纸变成蓝色,即可说明溶液中含有铵根离子,可确认溶液为硫酸铵溶液;
(4)①在工业上要把硫铁矿先碾成粉末可以促进硫铁矿的燃烧,原因是增大硫铁矿与空气的接触面积;
②解:根据反应的过程涉及的方程式为:4FeS2+11O2
2Fe2O3+8SO2; 2SO2+O2
2SO3; SO3+H2O═H2SO4;2NH3+H2SO4=(NH4)2SO4;因此FeS2和(NH4)2SO4的反应关系是
设需要含40% FeS2的硫铁矿的质量为x,
FeS2 ~2(NH4)2SO4
120 2×132
40%x 132g×20%
=
解之得:x=30g,
答:要制得132g20%(NH4)2SO4溶液,需含40% FeS2的硫铁矿的质量是30g.
故答案为:
【实验探究】(1)常温下Na2SO4溶液的溶质质量分数不可能达到20%;
(2)①NaOH;(NH4)2SO4溶液也呈酸性;
(3)
(4)①增大硫铁矿与空气的接触面积;②30.
| 19.5g |
| 19.5g+100g |
(2)硫酸镁、硫酸、硫酸铵三种物质中只有硫酸镁能与碱溶液氢氧化钠溶液形成氢氧化镁沉淀,因此,观察到出现白色沉淀就可判断溶液为硫酸镁溶液,说明所使用的试剂为氢氧化钠溶液;由于硫酸溶液、硫酸铵溶液都呈酸性的原因,测出溶液的pH小于7时,并不能就断定溶液为硫酸溶液,也可能是硫酸铵溶液;
(3)只要检验出溶液中含有铵根离子即可说明溶液为硫酸铵,因此可取溶液加入少量氢氧化钠溶液,然后在试管口放一张湿润的红色石蕊试纸,观察到有刺激性气味气体产生、试纸变成蓝色,即可说明溶液中含有铵根离子,可确认溶液为硫酸铵溶液;
(4)①在工业上要把硫铁矿先碾成粉末可以促进硫铁矿的燃烧,原因是增大硫铁矿与空气的接触面积;
②解:根据反应的过程涉及的方程式为:4FeS2+11O2
| ||
| ||
设需要含40% FeS2的硫铁矿的质量为x,
FeS2 ~2(NH4)2SO4
120 2×132
40%x 132g×20%
| 120 |
| 40%x |
| 2×132 |
| 132g×20% |
解之得:x=30g,
答:要制得132g20%(NH4)2SO4溶液,需含40% FeS2的硫铁矿的质量是30g.
故答案为:
【实验探究】(1)常温下Na2SO4溶液的溶质质量分数不可能达到20%;
(2)①NaOH;(NH4)2SO4溶液也呈酸性;
(3)
| 实验操作 | 实验现象 | 实验结论 |
| 向试管中加入少量的NaOH溶液,然后将湿润的红色石蕊试纸放在试管口 | 有刺激性气味的气体产生,红色石蕊试纸变蓝 | (NH4)2SO4+2NaOH =Na2SO4+2NH3↑+2H2O |
点评:本题涉及基础知识和技能较多,熟练掌握饱和溶液溶质质量分数与溶解度的关系、铵根的检验、溶液酸碱性与pH关系等知识是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
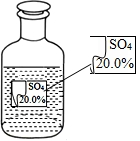 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液导电是什么溶液?
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液导电是什么溶液?提出猜想:
王老师提示:这瓶无色溶液只能是下了四种溶液中的一种:
①硫酸镁溶液、②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
查阅资料:
(1)常温下,相关物质的溶解度如下:
| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
实验探究:
(1)通过查阅资料,小明同学认为猜想
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验操作 | 实验现象 | 实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 |
溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸水,并跟比色卡对照 | 溶液pH小于7 |
猜想③成立 |
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少许于试管中, |
猜想④成立,该反应的化学方程式为 |
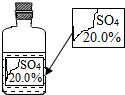 (2013?齐河县一模)一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液究竟是什么溶液?
(2013?齐河县一模)一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液究竟是什么溶液? 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.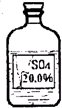 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液是什么溶液?
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液是什么溶液?