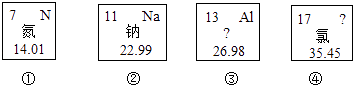
��Ŀ����
����Ŀ��������ұ��������������һ����Ҫ��־��ͼ1��ʵ����ģ��������װ��ͼ�� 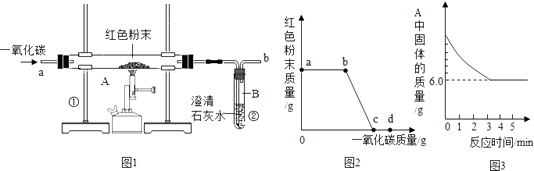
��1��д��ͼ1��A�������Ļ�ѧ��Ӧ����ʽ����
��2��ʵ�������ͨ��CO�������ɫ��ĩ�����Ĺ�ϵ��ͼ2��ʾ������ͼʾ������˵������ȷ������������ţ� ��a���ʾ��ʼͨ��CO����Ӧ��ʼ������
��b���ʾͨ��COһ��ʱ�����ȣ���Ӧ��ʼ������
��c���ʾ��ɫ��ĩ�ѳ�ֲμӷ�Ӧ��
��d���ʾ��Ӧ�������������ͨ��CO��
�ݿɸ���ͨ��CO�������������ɫ��ĩ��������
��3��ͼ1װ���еIJ���֮���� ��
��4����ʵ�����Ƶ����빤ҵ���Ƴ��������������� ��
��5��ij��ѧС���ͬѧ����������ʵ���һ�ݹ�����Ʒ������̽����ͨ��ʵ����ȷ������Ʒ�������������ۻ�϶��ɣ�����ȡ��7.2g������Ʒ����ͼ1��ʾ��װ������ʵ�飬�ⶨ�IJ���������ͼ3��ʾ����ԭ��Ʒ����Ԫ������Ԫ�ص��������� ��
���𰸡�
��1��Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
��2���٢�
��3��û�ж�β�����д���
��4����ʵ�����Ƶ����Ǵ������ҵ���Ƶ������ǻ�������һ������̼
��5��5��1
���������⣺��1����ɫ��ĩ������������������һ����̼�ڸ����������������Ͷ�����̼������ʽ�ǣ�Fe2O3+3CO ![]() 2Fe+3CO2�� ���Դ��ǣ�Fe2O3+3CO
2Fe+3CO2�� ���Դ��ǣ�Fe2O3+3CO ![]() 2Fe+3CO2����2��ʵ�鿪ʼ��ͨ��һ����̼���ž��Թ��ڿ�������ֹ���ȷ�����ը����Ӧ���Ҫ����ͨһ����̼����ֹ���ɵ�����������������һ����̼��δ������Ӧ�����Բ��ܸ���ͨ��һ����̼������ ���м��㣬a��b��ɫ��ĩ������δ�䣬˵����Ӧ��δ��ʼ��
2Fe+3CO2����2��ʵ�鿪ʼ��ͨ��һ����̼���ž��Թ��ڿ�������ֹ���ȷ�����ը����Ӧ���Ҫ����ͨһ����̼����ֹ���ɵ�����������������һ����̼��δ������Ӧ�����Բ��ܸ���ͨ��һ����̼������ ���м��㣬a��b��ɫ��ĩ������δ�䣬˵����Ӧ��δ��ʼ��
��ѡ�٢ݣ���3��һ����̼�ж���δ������Ӧ��һ����̼Ҫ���д�����ͼ��ȱ��β������װ�ã�
���Դ��ǣ�û�ж�β�����д�������4����ҵ���Ƶ�������������һ������̼���˴����Ƶ��Ǵ���������һ���Ǵ����һ���ǻ���
���Դ��ǣ���ʵ�����Ƶ����Ǵ������ҵ���Ƶ������ǻ�������һ������̼����5��һ����̼����������Ӧ�������Ͷ�����̼�����Բ����ܹ�����ٵ�����������������Ԫ�ص�������
�⣺��������������Ϊx��
3CO+Fe2O3 | 2Fe+3CO2 | ������ٵ����� |
160 | 112 | 160��112=48 |
x | 7.2g��6g |
![]() =
= ![]()
x=4g
������Ʒ�����۵�������7.2g��4g=3.2g
��Ʒ��FeԪ����������3.2g+4g�� ![]() ��100%=6g
��100%=6g
OԪ����������4g�� ![]() ��100%=1.2g
��100%=1.2g
������Ʒ����Ԫ������Ԫ�ص��������ǣ�6g��1.2g=5��1
�����㾫����������Ĺؼ���������һ����̼��ԭ�����������֪ʶ������ԭ�����ڸ����£����ý�̿��������Ӧ���ɵ�һ����̼����������ʯ�ﻹԭ�������Լ�������ұ�������⣬�˽���ұ����ԭ�ϣ�����ʯ����̿��ʯ��ʯ������������������ʯ�д�������Ҫ�ɷ���Fe3O4 ������������Ҫ�ɷ���Fe2O3 ����

 �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�