题目内容
(2007?永春县质检)我国有一些的古代建筑保存完好,这与所用的建筑材料有关.某学习小组从某古代建筑维修现场搜集了一些旧墙灰进行研究.取12.0g旧墙灰(主要成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假设其他杂质不参加反应,不考虑H2O、HCl逸出).反应开始时,烧杯及所盛物质的总质量为300.0g.实验数据记录如下:| 反应时间/min | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | |
| 烧杯及所盛物质总质量/g | 300.0 | 299.0 | 298.0 | 297.2 | 296.5 | 296.0 | 295.7 | 295.6 | m | 295.6 |
(2)反应生成CO2的总质量为______g.
(3)该旧墙灰中CaCO3的质量分数.
(反应化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)
【答案】分析:(1)根据图表中14min和18min时的数据推断M的值;
(2)根据质量守恒定律,反应生成CO2的总质量=反应前物质质量总和-反应后物质质量总和;
(3)根据碳酸钙与盐酸反应的化学方程式和生成二氧化碳的质量,列出比例式,就可计算出该旧墙灰中CaCO3的质量;然后根据质量分数公式计算即可.
解答:解:(1)由图表数据可得,14min和18min时,烧杯及所盛物质的总质量都为295.6g,说明14min时反应已完全.故M=295.6g;
故答案为:295.6;
(2)根据质量守恒定律,反应生成CO2的总质量=300.0g-295.6g=4.4g;
故答案为:4.4;
(3)解:设该旧墙灰中CaCO3的质量为X,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g
∴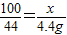 ,
,
解之得:X= =10g;
=10g;
则该旧墙灰中CaCO3的质量分数= ×100%=83.3%.
×100%=83.3%.
答:该旧墙灰中CaCO3的质量分数为83.3%.
点评:本题主要考查学生利用化学方程式和质量守恒定律解答问题的能力.根据质量守恒定律,可以计算出反应中生成气体和沉淀的质量,为解题打开突破口.
(2)根据质量守恒定律,反应生成CO2的总质量=反应前物质质量总和-反应后物质质量总和;
(3)根据碳酸钙与盐酸反应的化学方程式和生成二氧化碳的质量,列出比例式,就可计算出该旧墙灰中CaCO3的质量;然后根据质量分数公式计算即可.
解答:解:(1)由图表数据可得,14min和18min时,烧杯及所盛物质的总质量都为295.6g,说明14min时反应已完全.故M=295.6g;
故答案为:295.6;
(2)根据质量守恒定律,反应生成CO2的总质量=300.0g-295.6g=4.4g;
故答案为:4.4;
(3)解:设该旧墙灰中CaCO3的质量为X,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g
∴
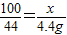 ,
,解之得:X=
 =10g;
=10g;则该旧墙灰中CaCO3的质量分数=
 ×100%=83.3%.
×100%=83.3%.答:该旧墙灰中CaCO3的质量分数为83.3%.
点评:本题主要考查学生利用化学方程式和质量守恒定律解答问题的能力.根据质量守恒定律,可以计算出反应中生成气体和沉淀的质量,为解题打开突破口.

练习册系列答案
相关题目
(2007?永春县质检)人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.
(1)日常生活中,用于保护钢铁制品所使用的“银粉”实际上是金属的粉末;家里热水内胆的夹层内壁上涂的金属是;温度计中填充的金属是;灯泡中的灯丝是金属.
(2)根据下图的金属应用实例推断,金属具有的物理性质有、.(写出两种)

(3)日常使用的金属材料多数属于合金.下表列出了一些常见合金的主要成分和性能.
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号).
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
(4)人们每年要从金属矿物资源中提取数以亿吨计的金属.根据所学化学知识,写出一个生成金属的置换反应化学方程式.
(1)日常生活中,用于保护钢铁制品所使用的“银粉”实际上是金属的粉末;家里热水内胆的夹层内壁上涂的金属是;温度计中填充的金属是;灯泡中的灯丝是金属.
(2)根据下图的金属应用实例推断,金属具有的物理性质有、.(写出两种)

(3)日常使用的金属材料多数属于合金.下表列出了一些常见合金的主要成分和性能.
| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁抗锈蚀性能不如不锈钢. |
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
(4)人们每年要从金属矿物资源中提取数以亿吨计的金属.根据所学化学知识,写出一个生成金属的置换反应化学方程式.