题目内容
实验室用130g锌粒与足量的稀硫酸反应制取氢气.请计算:(1)生成氢气的质量是多少克?
(2)这些氢气在标准状况下的体积是多少升?(已知标准状况下氢气的密度为0.0899g/L)[提示:有关反应的化学方程式为[Zn+H2SO4=ZnSO4+H2↑].
【答案】分析:(1)欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出生成氢气的质量.
(2)根据体积=质量÷密度计算即可.
解答:解:(1)设生成氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
130g x
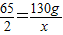
x=4g.
(2)根据v=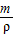 得氢气的体积为
得氢气的体积为
4g÷0.0899g/L=44.8L.
答:生成氢气的质量为4克,这些氢气在标准状况下的体积是44.8升.
点评:此题是根据化学方程式的计算题,我们计算的依据是化学方程式,所以务必要保证我们的出发点即化学方程式要书写正确,然后再根据相对分子质量的比进行求算.
(2)根据体积=质量÷密度计算即可.
解答:解:(1)设生成氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
130g x
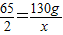
x=4g.
(2)根据v=
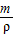 得氢气的体积为
得氢气的体积为4g÷0.0899g/L=44.8L.
答:生成氢气的质量为4克,这些氢气在标准状况下的体积是44.8升.
点评:此题是根据化学方程式的计算题,我们计算的依据是化学方程式,所以务必要保证我们的出发点即化学方程式要书写正确,然后再根据相对分子质量的比进行求算.

练习册系列答案
相关题目