题目内容
钢铁在生产、生活中有着广泛的应用。
(1)钢铁属于_________(填“纯净物”或“混合物”);钢铁在空气中锈蚀是铁跟空气中的水蒸气和_________共同作用的结果。为了防止钢铁的锈蚀,人们除采用在其表面涂油漆的方法外,还可_________(任填一种方法);工业上用稀盐酸除去铁锈(主要成分为Fe2O3),写出该反应的化学方程式:_________________________。
(2)某钢铁厂为分析赤铁矿中Fe2O3的质量分数:准确称取20g样品,在高温条件下用足量CO气体还原,充分反应(假设其他杂质不与CO反应)后冷却、称重,质量为15.2g。计算该赤铁矿样品中Fe2O3的质量分数。
(1)钢铁属于_________(填“纯净物”或“混合物”);钢铁在空气中锈蚀是铁跟空气中的水蒸气和_________共同作用的结果。为了防止钢铁的锈蚀,人们除采用在其表面涂油漆的方法外,还可_________(任填一种方法);工业上用稀盐酸除去铁锈(主要成分为Fe2O3),写出该反应的化学方程式:_________________________。
(2)某钢铁厂为分析赤铁矿中Fe2O3的质量分数:准确称取20g样品,在高温条件下用足量CO气体还原,充分反应(假设其他杂质不与CO反应)后冷却、称重,质量为15.2g。计算该赤铁矿样品中Fe2O3的质量分数。
(1)混合物 氧气 制成合金 Fe2O3+6HCl=2FeCl3+3H2O (2)80%
(1)钢铁是碳合金,属于混合物;钢铁生锈是铁和空气中的水蒸气、氧气共同作用的结果;防止铁生锈的方法有保持钢铁制品表面洁净干燥、在表面涂油刷漆、镀金属保护层、搪瓷等,还可以制成不锈钢;盐酸除铁锈发生的是复分解反应:Fe2O3+6HCl=2FeCl3+3H2O,不能把FeCl3写成FeCl2。(2)铁矿石减轻的质量(20g-15.2g=4.8g)是氧化铁中失去的氧元素的质量,根据化学式Fe2O3可计算出Fe2O3的质量和纯度:Fe2O3的质量为4.8g÷(48/160×100%)=16g,Fe2O3纯度为16g÷20g×100%=80%,也可以根据化学方程式计算出Fe2O3的质量,但要注意代入化学方程式的必须是纯净物的质量。
(2)解:设含杂质质量为X
3CO + Fe2O3 2Fe+ 3CO2
2Fe+ 3CO2
160 112
20g-X 15.2g-X
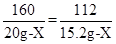
X=4g
Fe2O3%=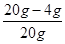 ×100%=80%
×100%=80%
(2)解:设含杂质质量为X
3CO + Fe2O3
 2Fe+ 3CO2
2Fe+ 3CO2160 112
20g-X 15.2g-X
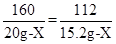
X=4g
Fe2O3%=
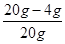 ×100%=80%
×100%=80%
练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 O2↑+2H2O.请计算:
O2↑+2H2O.请计算: