题目内容
氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸铁工艺流程如下:(提示:溶液中当pH=3.8时硫酸铁全部转化为Fe(OH)3沉淀,pH=6.4时硫酸铜全部转化为Cu(OH)2沉淀)

(1)氧化铜矿石粉碎的目的是____ 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的化学方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)Fe(OH)3与硫酸反应的化学方程式 。
(6)“烘干粉碎”的实验结果如表所示。
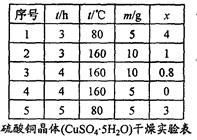
表中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O脱水得流程中所示产品的适宜工艺条件分别为 、 (分别指出温度和时间)。

(1)氧化铜矿石粉碎的目的是____ 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的化学方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)Fe(OH)3与硫酸反应的化学方程式 。
(6)“烘干粉碎”的实验结果如表所示。

表中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O脱水得流程中所示产品的适宜工艺条件分别为 、 (分别指出温度和时间)。
(1)增大接触面积,加快反应速率;
(2) Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑;
(3)适当降低溶液的酸性,是Fe(OH)3形成沉淀,而硫酸铜不形成沉淀而分离;
(4)烧杯、玻璃棒、漏斗;
(5) 盐酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+6H2O;
(6)160℃,3h。
(2) Cu2(OH)2CO3+2H2SO4==2CuSO4+3H2O+CO2↑;
(3)适当降低溶液的酸性,是Fe(OH)3形成沉淀,而硫酸铜不形成沉淀而分离;
(4)烧杯、玻璃棒、漏斗;
(5) 盐酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+6H2O;
(6)160℃,3h。
试题分析:(1)反应物间的接触面积越大,反应越充分,故氧化铜矿石粉碎的目的是增大接触面积,加快反应速率;
(2)依据质量守恒定律化学反应前后元素的质量不变,生成物是硫酸铜、水和二氧化碳气体;
(3)该实验的目的是联合生产硫酸铜和硫酸亚铁,硫酸铜通过滤液蒸发结晶,烘干粉碎可以制取,因此硫酸亚铁由另一条线获得,经“中和/过滤”所得滤渣应该是含铁的沉淀——Fe(OH)3,由于前一步只加入KMnO4,目的是将溶液中的Fe2+氧化为Fe3+,根据题目所给条件“中和/过滤”,很容易想到用CaCO3中和过量的硫酸,降低了溶液的酸性, 促进Fe3+形成沉淀Fe(OH)3而除出;
(4)过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗;
(5)Fe(OH)3与硫酸发生中和反应,生成盐和水,故反应生成的是硫酸铁和水;
(6)根据表可知,由CuSO4·5H2O脱水制CuSO4·H2O,那么X应该是1,温度应选160℃,时间选3h。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目