题目内容
相对原子质量:H 1 S 32 O 16 Zn 65根据如图所示的信息计算:

(1)根据质量守恒定律,可知产生氢气的质量______g
(2)所用稀硫酸的溶质质量分数.(化学方程式:Zn﹢H2SO4=Zn SO4﹢H2↑)
【答案】分析:(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的氢气的质量,可以据此解答;
(2)根据生成的氢气的质量结合反应的化学方程式可以计算出稀硫酸中硫酸的质量,然后求出其质量分数即可.
解答:解:(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的氢气的质量,即为:100g+2g-119.8g=0.2g;
(2)设稀硫酸中溶质的质量为x
Zn﹢H2SO4═ZnSO4﹢H2↑
98 2
x 0.2g
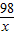 =
=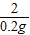
解得:x=9.8g
所以所用稀硫酸的溶质质量分数为: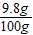 ×100%=9.8%
×100%=9.8%
答:所用稀硫酸的溶质质量分数为9.8%.
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氢气的质量.
(2)根据生成的氢气的质量结合反应的化学方程式可以计算出稀硫酸中硫酸的质量,然后求出其质量分数即可.
解答:解:(1)根据质量守恒定律可以知道,反应前后减少的质量为生成的氢气的质量,即为:100g+2g-119.8g=0.2g;
(2)设稀硫酸中溶质的质量为x
Zn﹢H2SO4═ZnSO4﹢H2↑
98 2
x 0.2g
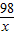 =
=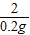
解得:x=9.8g
所以所用稀硫酸的溶质质量分数为:
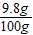 ×100%=9.8%
×100%=9.8%答:所用稀硫酸的溶质质量分数为9.8%.
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氢气的质量.

练习册系列答案
相关题目