题目内容
【题目】氯化亚铜CuCl是一种难溶于水和乙醇,在潮湿空气中易变质的物质,广泛应用于治金、电镀、医药等行业。CuC1的制备流程如下:
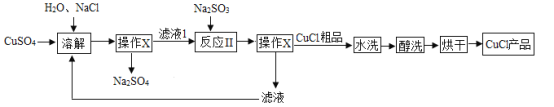
(1)Na2SO3中硫元素的化合价为_____;
(2)“操作X”中需要用到玻璃棒,其作用是_____;
(3)“滤液”中除了Na+、SO42﹣外,还存在较多的离子是_____(写离子符号);
(4)“反应“中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3可与水化合生成一种常见的酸,该反应的化学方程式为_____;
(5)上述流程中可以循环利用的物质(水除外)是_____(写化学式);
(6)可用“水洗”的原因是_____。“醇洗”的目的是_____,防止洗涤过程中氯化亚铜变质。
【答案】+4 引流 Cu2+、Cl﹣ SO3+H2O=H2SO4 NaCl 氯化亚铜难溶于水,水洗能够除去可溶性杂质 可以除去水,防止在后续步骤中CuCl变质。
【解析】
(1)Na2SO3中钠元素为+1价,而氧元素为﹣2价,根据化合物中各元素化合价的代数和为零,可得硫元素的化合价为+4;
(2)通过过滤可将难溶于水的固体物质和液体分离,所以“操作a”是过滤;
(3)根据后面的反应可知,“滤液1”中除了Na+、SO42﹣外,还存在较多的离子是 Cu2+、Cl﹣。
(4)SO3与水发生化合反应生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4。
(5)根据流程可知,可以循环利用的物质(水除外)是NaCl。
(6)由于氯化亚铜CuCl难溶于水,所以可用“水洗”除去可溶性杂质;CuCl在潮湿空气中易变质,“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质。
故答案为:(1)+4;(2)引流;(3)Cu2+、Cl﹣;(4)SO3+H2O=H2SO4;(5)NaCl;(6)氯化亚铜难溶于水,水洗能够除去可溶性杂质; 可以除去水,防止在后续步骤中CuCl变质。

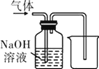
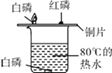
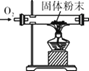
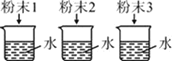
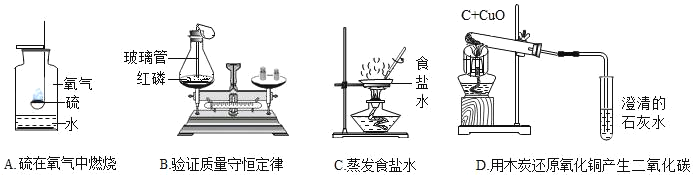
【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. AB. BC. CD. D
【题目】下表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | 氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 |
硝酸钾 | 31.6 | 63.9 | 110.0 | 169.0 | |
(1)两种物质中,溶解度的变化受温度影响较小的是_____。
(2)20℃时向100g水中加入25g氯化钠充分溶解,所得溶液中溶质的质量分数为_____。
(3)使接近饱和的硝酸钾溶液变为饱和溶液的一种方法是_____。
(4)60℃时,硝酸钾饱和溶液中溶有少量氯化钠,提纯硝酸钾的方法是_____。
【题目】下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
(1)两种物质中,溶解度受温度影响变化较大的是______(填化学式)。
(2)60℃时,按图示操作:

A中溶质是_______(填“饱和”或“不饱和”)溶液,C中溶液的总质量是________g。
(3)50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液________(填“大于”“等于”或“小于”) KNO3溶液。
(4)由表中数据可知,若KNO3和NaCl在T℃时具有相同的溶解度Xg,则X最小的取值范围是____(用数学表达式表示,下同),T最小的取值范围是______