题目内容
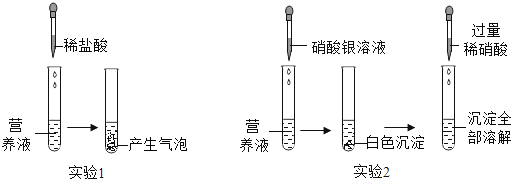
【题目】硫酸铜是制备其他含铜化合物的重要原料。工业上用废铜屑、氧气和稀硫酸反应制取硫酸铜。
(1)请将工业制取硫酸铜的化学方程式补充完整:2Cu+O2+2H2SO4=2CuSO4+________。
(2)某化工厂现有含铜量80%的废铜屑(假设废铜屑中杂质不参加反应)和稀硫酸。试计算制取160kg硫酸铜需要废铜屑的质量为_____(写出计算过程及结果)。
【答案】2H2O 80kg
【解析】
(1)根据反应前后原子的种类和个数不变分析解答;
(2)根据硫酸铜的质量计算出铜的质量,进而计算需要废铜屑的质量。
解:(1)根据反应前后原子的种类和个数不变,空白处应为2H2O;
(2)解:设需要的Cu质量为x,
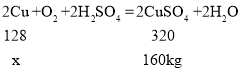
![]()
x=64kg;
废铜屑的质量=64kg÷80%=80kg;
答:需要废铜屑的质量80kg。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目