题目内容
【题目】早在春秋战国时期,我国就开始生产和使用铁器。工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
一氧化碳还原氧化铁的化学方程式为: 。其中,石灰石起的作用是 。
(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为 。为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】
焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【进行实验】
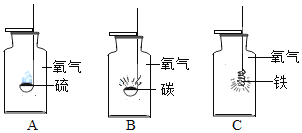
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。
②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先 (选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是 。
【实验现象】
当图1装置B的玻璃管中固体完全由 时(选填“红色变为黑色”或“黑色变为红色”),图1装置A的试管中仍有 。
【解释与结论】
焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【完善实验】
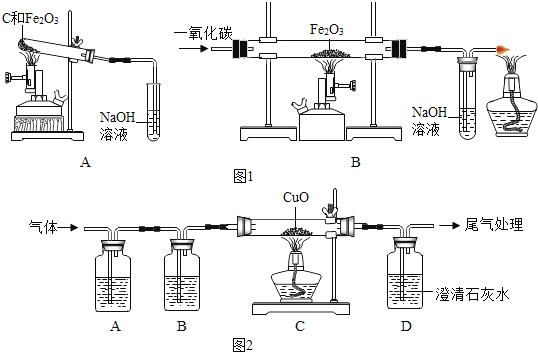
联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是(写名称,下同) ,图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式 ;证明原混合气体中CO存在的实验现象是 ;经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。
(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】
利用绿矾制备精还原铁粉的工艺流程如下:
![]()
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为
FexOy+yH2![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2![]() 3Fe+CH4。
3Fe+CH4。
【含量测定】
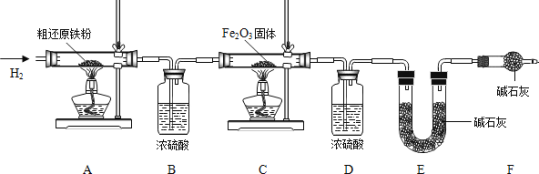
为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。
已知3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(1)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃酒精灯, (填“先点A处,后点C处”或“先点C处,后点A处”);
④分别熄灭A处、C处酒精灯;
⑤再缓缓通入少量H2;
⑥再次称量必要装置的质量
(2)步骤②的目的是 ,验证该步骤目的达到的实验方法是 ;
(3)若缺少装置D,则所测氧元素的质量分数将 (填“偏大”,“偏小”或“不变”)。
(4)粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是 。(列出计算过程,2分)
【答案】3CO+Fe2O3![]() 2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的。
2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的。
(一)【提出问题】3C+2Fe2O3高温4Fe+3CO2↑
【进行实验】②通CO;防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。
【实验现象】红色变为黑色;红色物质。
【完善实验】澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;黑色粉末变成红色。
(二)(1)③先点C处,后点A处。(2)排尽空气,防止爆炸;收集尾气,进行验纯。
(3)不变(4)w(C)=0.6%;w(O)=1.6%。
【解析】
试题分析∶根据所学知识和题中信息知,工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为:3CO+Fe2O3高温2Fe+3CO2;其中,石灰石起的作用是将矿石中的二氧化硅等杂质转变为炉渣而除去的。(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为3C+2Fe2O3高温4Fe+3CO2↑。为什么工业上不用焦炭作为还原剂直接还原铁矿石?【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。【进行实验】①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先通CO;实验结束后应继续通入CO直至冷却至室温,其原因是防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。【实验现象】当图1装置B的玻璃管中固体完全由红色变为黑色时;图1装置A的试管中仍有红色物质。【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。【完善实验】甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是澄清石灰水;图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式是Ca(OH﹚2+CO2=CaCO3↓+H2O;证明原混合气体中CO存在的实验现象是黑色粉末变成红色。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2高温xFe+yH2O,Fe3C+2H2高温3Fe+CH4。【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。已知3CH4+4Fe2O3高温3CO2+6H2O+8Fe(1)主要实验步骤如下:①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②缓缓通入纯净干燥的H2;③点燃酒精灯,先点C处,后点A处。④分别熄灭A处、C处酒精灯;⑤再缓缓通入少量H2;⑥再次称量必要装置的质量。(2)步骤②的目的是排尽空气,防止爆炸;验证该步骤目的达到的实验方法是收集尾气,进行验纯。(3)若缺少装置D,则所测氧元素的质量分数将不变。(4)粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是∶0.330g×﹙12/44×100%﹚/15.0g×100%=0.6%;0.270g×﹙16/18×100%﹚/15.0g×100%=1.6%。
考点∶考查实验探究的基本思路和方法。

【题目】盛过石灰水的试剂瓶,用完后瓶壁上附有白色物质,洗涤该试剂瓶的方法是
A.先用水冲洗,再用稀盐酸冲洗
B.先用稀盐酸冲洗,再用水冲洗
C.先用肥皂洗,再用水冲洗
D.先用玻璃棒去掉白色物质,再用水冲洗
【题目】室验室开放日,小明、小佳、小华、小丽等同学来到实验室,看到实验桌上摆放着四瓶无标签的试剂,分别是两瓶固体和两瓶液体,同学们决定对“固体与液体”之间的反应进行一系列探究.
(1)小明同学从一瓶固体和一瓶液体中各取少量试剂于试管中进行混合,立即产生了一种无色气体,对气体是何物质,同学们进行了大胆的猜想,小佳同学的猜想可能是①__________;②__________;….
(2)我想设计一个实验证明小佳同学猜想①是正确的,实验设计如下:
实验步骤 | 现象及结论 |
______________ | ______________ |
(3)小华想用如图给定的收集装置收集一瓶小佳同学猜想②中的气体,则气体由______________(填a或b)端进入.

(4)小丽同学从另外两瓶试剂中各取少量试剂于试管中,发现混合后,固体发生了变化,但无气泡放出.同学们对加入试管中的固体和液体从不同的反应类型、物质类别等方面进行了大胆的猜想:
猜想一:______________;
猜想二:______________;
猜想三:______________;….