题目内容
(2007?扬州)下列气体能用如图装置制取,并能实现“随开随用、随关随停”的是( )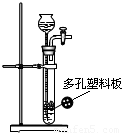
【答案】分析:A、碳酸钠制取二氧化碳,反应速率太快,不易收集;
B、锌粒和稀硫酸制取氢气,反应速率适中;
C、铁粉和稀硫酸制取氢气,反应太慢;
D、大理石和稀硫酸制取二氧化碳,开始反应,过一会便不反应.
解答:解:A、碳酸钠和稀硫酸制取二氧化碳,反应速率太快,不易收集,且由于碳酸钠是粉末,不能实现“随开随用、随关随停”,故A错误;
B、锌粒和稀硫酸制取氢气,反应速率适中,能实现“随开随用、随关随停”,故B正确;
C、铁粉和稀硫酸制取氢气,反应太慢,铁粉是粉末状的,不能实现“随开随用、随关随停”,故C错误;
D、大理石和稀硫酸制取二氧化碳,开始反应,过一会形成硫酸钙覆盖在大理石表面,阻止了进一步反应,则不能实现“随开随用、随关随停”,故D错误
故选B.
点评:了解气体制取装置的选择和连接方法;掌握二氧化碳和氢气的实验室制取原理和检验方法.
B、锌粒和稀硫酸制取氢气,反应速率适中;
C、铁粉和稀硫酸制取氢气,反应太慢;
D、大理石和稀硫酸制取二氧化碳,开始反应,过一会便不反应.
解答:解:A、碳酸钠和稀硫酸制取二氧化碳,反应速率太快,不易收集,且由于碳酸钠是粉末,不能实现“随开随用、随关随停”,故A错误;
B、锌粒和稀硫酸制取氢气,反应速率适中,能实现“随开随用、随关随停”,故B正确;
C、铁粉和稀硫酸制取氢气,反应太慢,铁粉是粉末状的,不能实现“随开随用、随关随停”,故C错误;
D、大理石和稀硫酸制取二氧化碳,开始反应,过一会形成硫酸钙覆盖在大理石表面,阻止了进一步反应,则不能实现“随开随用、随关随停”,故D错误
故选B.
点评:了解气体制取装置的选择和连接方法;掌握二氧化碳和氢气的实验室制取原理和检验方法.

练习册系列答案
相关题目
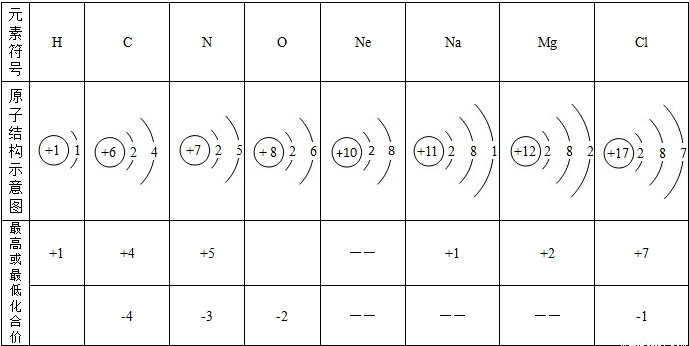
(2007?扬州)(1)知识在于积累.下面是玲玲制作的化学知识卡片,请将其补充完整.
、、、.
(2)甲醇汽油可以减少汽车尾气对环境的污染.某化工厂以甲烷为原料合成甲醇 (CH3OH),并将多余的氢气用于合成氨.请书写有关化学反应方程式:
①甲烷和水蒸气在一定条件下制得CO、H2;
②CO、H2在一定条件下化合成甲醇;
③高温高压、催化剂的条件下,氮气和氢气合成氨.
、、、.
| 专题2:物质性质和用途 No:WZ09 摘录时间2011年3月20日 工业用盐 致癌作用 含+3价氮 该物质式为________ 制取氧气 暗紫色固体 可用于消毒盐 该物质式为________ 无色无味 剧毒气体 与血红蛋白结合 该物质式为________ 一种氮肥 含氮 35% 溶于水温度下降 该物质式为________ |
①甲烷和水蒸气在一定条件下制得CO、H2;
②CO、H2在一定条件下化合成甲醇;
③高温高压、催化剂的条件下,氮气和氢气合成氨.

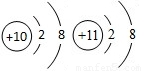 两者关系是.(填字母) A.同种元素 B.不同种元素.
两者关系是.(填字母) A.同种元素 B.不同种元素.