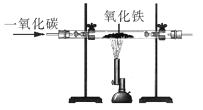
题目内容
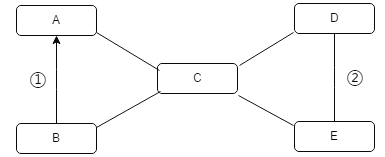
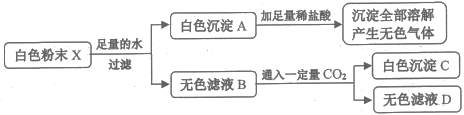
【题目】有一包白色粉末X,由CaCO3、BaCl2、Na2SO4、CuSO4、NaOH中的两种或两种以上的物质混合而成。为探究其组成,进行如下实验(实验流程如图):
下列叙述中正确的是
A. 白色粉末X中,可能含有NaOH
B. 白色粉末X中,一定含有CaCO3、BaCl2和Na2SO4
C. 白色粉末X中,一定不含有CuSO4和Na2SO4
D. 若白色粉末X质量为40g,无色滤液D中溶质只有一种,产生白色沉淀C质量为19.7g,则白色沉淀A的质量为11.2g
【答案】CD
【解析】
白色粉末X由CaCO3、BaCl2、Na2SO4、CuSO4、NaOH中的两种或两种以上的物质混合而成,根据加足量水过滤得到无色滤液可知粉末中一定不含硫酸铜,因为硫酸铜溶液是蓝色的;再根据白色沉淀加足量稀盐酸全部溶解且有无色气体生成,说明粉末中含有碳酸钙,即白色沉淀A,粉末中不能同时存在氯化钡和硫酸钠,因为氯化钡和硫酸钠反应生成的硫酸钡不仅难溶于水且难溶于酸;根据无色滤液B通入一定量二氧化碳能得到白色沉淀,说明粉末中含有氯化钡和氢氧化钠,不含硫酸钠,白色沉淀C是二氧化碳和氢氧化钠反应生成的碳酸钠,再和氯化钡反应生成的碳酸钡沉淀,即白色粉末中含有CaCO3、BaCl2和NaOH,不含Na2SO4和CuSO4,
A、由上分析可知,白色粉末X中,一定含有NaOH,故不符合题意;
B、白色粉末X中一定含有CaCO3、BaCl2,但是不含有Na2SO4,故不符合题意;
C、白色粉末X中一定不含有CuSO4和Na2SO4,故符合题意;
D、由上分析可知,若无色滤液D中溶质只有一种氯化钠,说明粉末中的氢氧化钠和二氧化碳反应生成的碳酸钠和氯化钡恰好完全反应,根据物质间反应的转化关系设粉末中氢氧化钠质量为x,氯化钡质量为y,

![]() =
=![]()
![]() =
=![]()
x=8.0g
y=20.8g
则粉末中碳酸钙质量=40g-8.0g-20.8g=11.2g,故符合题意。

【题目】小丽对家中的家用制氧机产生了浓厚的兴趣。她通过阅读说明书了解到家用制氧机的工作原理如下:在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验Ⅰ:验证气体的性质。
把一根蜡烛插入到盛有该气体的集气瓶中,观察到蜡烛燃烧更旺,发出_____、_____、并产生两种新物质。反应的表达式为_____。
实验Ⅱ:测定气体中氧气的含量。
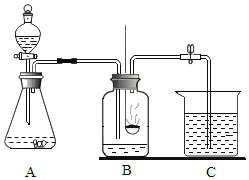
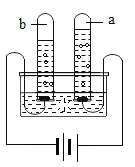
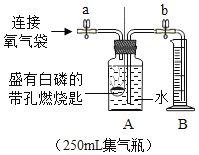
小丽设计了如图所示装置,加入一定量的白磷。检查并确定装置的气密性良好,然后进行实验,并重复多次。(实验过程中由压强差引起的误差忽略不计)
实验步骤:
①加入药品,将装置连接固定
②打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b,观察A中水进入到B中,B中水的体积为200mL。
③用凸透镜聚光引燃白磷
④待白磷熄灭并冷却到室温,再_____(填写实验步骤),观察到_____的现象,说明收集的气体不是纯净的氧气。
⑤记录B中剩余水的体积。
实验次序 | 1 | 2 | 3 | 4 | 5 |
B中剩余水体积/mL | 100 | 41 | 38 | 42 | 39 |
数据处理和
(1)在上表数据中,第_____次的数据偏差较大,导致产生较大误差的原因是实验时_____。
(2)其余4组数据取平均值来进行计算,该家用制氧机制得的气体中氧气的体积分数为_____%。