题目内容
【题目】通过一年的化学学习,你已经掌握了实验室制取气体的有关知识.请结合下列装置图回答问题:

(1)仪器①的名称是_____
(2)实验室用装置A制取CO2,使用的药品是稀盐酸和_____(填名称).收集CO2不选用装置B的原因是_____。
(3)实验室用锌粒和稀硫酸制取氢气,_____ (填“能”或“不能”)选择A为发生装置。
【答案】集气瓶 大理石或石灰石 二氧化碳气体能溶于水 能
【解析】
(1)仪器①的名称是:集气瓶;
(2)实验室用固液发生装置A制取CO2,使用的药品是稀盐酸和大理石(或石灰石)收集CO2不选用装置B的原因是二氧化碳气体能溶于水,不能用排水法收集气体;
(3)实验室用锌粒和稀硫酸制取氢气,锌粒是固体,稀硫酸是液体可以选择固液发生装置A。

【题目】某校化学研究性学习小组的同学在老师指导下开展了一系列探究物质组成的实验活动,请按要求回答问题:
探究活动一:探究空气中氧气的体积分数
(1)选用汞、磷、铜等物质均可以完成该实验,选择反应物的主要依据是(填序号)_________ ;
A 反应物是固体 B 在空气中反应且只消耗氧气
C 燃烧有明显现象 D 生成物不是气体
(2)用甲、乙两套装置进行实验(红磷充足、装置不漏气).
①红磷燃烧的文字表达式是________ ,下列有关分析合理的是 __________.
A 都只能在实验结束后,推测出氮气是无色气体
B 甲中燃烧匙伸入集气瓶太慢,测得空气中氧气的体积分数将偏大
C 乙中瘪气球可以防止燃烧放热使橡胶塞弹出
D 乙比甲更节约能源
②利用乙装置进行实验时,先关闭弹簧夹,加热使合力反应,待装置冷却至室温后打开弹簧夹,反应前后各数据及结论如下,请分析后将玻璃管中原有的空气体积填入空格内:
玻璃管中原有 空气的体积 | 注射器中气体的体积 | 结论 | |
反应前 | 反应后 | ||
_____ mL | 40 mL | 30 mL | 氧气约占空气体积的五分之一 |

探究活动二、探究水的组成
(1)如图1,是水通电分解的示意图,此实验可以探究水的组成.在实验过程中,观察到ab两玻璃管中产生气体的体积比为1:2,则a玻璃管连接的是电源的____ 极.
(2)还能说明组成水的元素种类的实验是 ______________.
探究活动三、探究不同物质的组成元素
为探究不同物质中可能含有相同元素,设计了如下两个实验:
(1)如图2,取少量白砂糖、面粉,分别放在燃烧匙中,在酒精灯上加热,直至完全烧焦,燃烧匙中所剩物质均呈黑色,由此可知白砂糖、面粉中都有 _________元素;
(2)如图3,加热碱式碳酸铜的实验过程中,观察到什么现象时也可说明碱式碳酸铜中含有与白砂糖、面粉相同的某种元素?________
以上实验可以用来推断物质的组成元素,试用微粒的观点分析设计这些实验的依据是 __________.

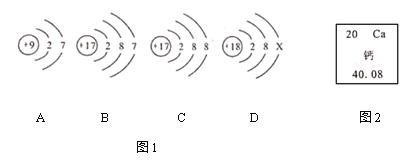
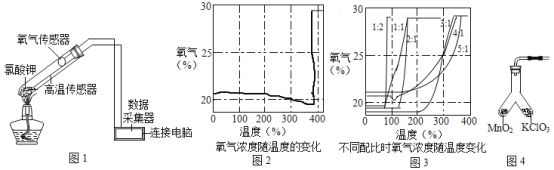
【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。
资料:①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
请回答问题:
(1)分析图2,氯酸钾分解温度__________(填“高于”、“等于”或“低于”)其熔点。
(2)分析图2,在氯酸钾分解前,传感器得到氧气浓度降低的可能原因是_________________。
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是_______________,当物质配比为1:2时,氯酸钾分解温度约为________℃。
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性。 | |
Ⅱ | 分别在“Y”形管两侧支管中加入少量二氧化锰和氯酸钾,塞紧橡皮塞。 | |
Ⅲ | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导管口。 | 加热左侧支管,可观察到_____, 加热右侧支管,可观察到_____。 |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤Ⅲ,木条很快复燃 |
请回答:
①完善步骤Ⅲ中的填空:加热左侧支管,可观察到______________,加热右侧支管,可观察到_________________。
②步骤Ⅳ中,将二氧化锰混入右侧支管有余热的氯酸钾中的操作方法是_______________。
③小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的符号表达式__________________。