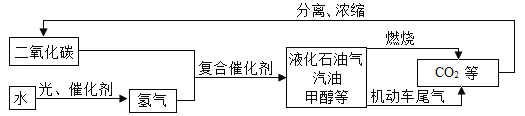
题目内容
【题目】A~H 是初中化学中的常见物质。
请结合它们之间的转化关系图,回答下列问题(图中“→”表示物质间存在转化关系)。
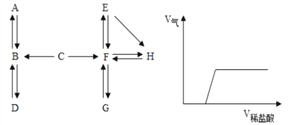
(1)A 在标准状况下是密度最小的气体,A 的化学式是_______;A、B、C 中含有同一种元素,C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是__________。
(2)D为气体单质,写出B→D的化学方程式___________________________________________。
(3)工业常用G→F反应炼铁,该反应的化学方程式是__________________________________。
(4)E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,产生气体体积与所加稀盐酸体积的关系如上图所示。滤液中的溶质是_______;写出F→E的化学方程式___________。
【答案】 H2 Fe2O3 2H2O 通电 2H2↑+ O2↑ Fe2O3 + 3CO高温 2Fe+3CO2 NaOH、Na2CO3 2NaOH + CO2 == Na2CO3 + H2O
【解析】根据密度最小的气体,可先推出A是氢气,由溶液呈黄色可推出溶液中含有铁离子,再根据“A、B、C中含有同一种元素”可推出B为水,C中含有氢元素,且能与含铁的化合物反应,所以C为盐酸,D为气体单质,B为水,可推出D为氧气,根据产生气体的图象可以推测,溶液中必定为可溶性碱和碳酸盐的混合物,还得保证该碳酸盐与该碱不反应,所以溶质为氢氧化钠与碳酸钠,进而推出H为碳酸钙,由于工业常用G→F反应炼铁,又因为GF可以相互转化,则F为二氧化碳,G为一氧化碳;所以,(1) A是氢气,化学式是H2;C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是Fe2O3 ;(2) B→D的化学方程式为:2H2O![]() 2H2↑+ O2↑;(3) G→F反应炼铁,该反应的化学方程式是:Fe2O3 + 3CO
2H2↑+ O2↑;(3) G→F反应炼铁,该反应的化学方程式是:Fe2O3 + 3CO![]() 2Fe+3CO2;(4) E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,反应开始一段时间后,产生气体,说明氢氧化钠过量,故滤液中含有氢氧化钠和碳酸钠;F→E的化学方程式为:2NaOH + CO2 == Na2CO3 + H2O。
2Fe+3CO2;(4) E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,反应开始一段时间后,产生气体,说明氢氧化钠过量,故滤液中含有氢氧化钠和碳酸钠;F→E的化学方程式为:2NaOH + CO2 == Na2CO3 + H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】某化学实验小组要测定一种纯碱样品中碳酸钠的含量,并用一定溶质质量分数的稀硫酸进行实验,记录实验数据如下(样品中杂质不含钠元素、不溶于水也不与硫酸反应)
第一次 | 第二次 | 第三次 | |
加入的稀硫酸的质量(g) | 100 | 100 | 100 |
加入的样品的质量(g) | 20 | 40 | 42 |
生成气体的质量(g) | 2.2 | a | 4.4 |
(1)上表中a=_________;
(2)根据已知条件列出求解第三次参加反应的纯碱的质量(x)的比例式__________;
(3)将第二次实验所得的溶液蒸发掉6.2g水,所得不饱和溶液中溶质的质量分数为___________;
(4)若配制实验中所用稀硫酸200g,需要用溶质质量分数为98%的浓硫酸的质量为________;
(5)这种纯碱样品中碳酸钠的质量分数为______________。