题目内容
【题目】根据下列装置回答问题。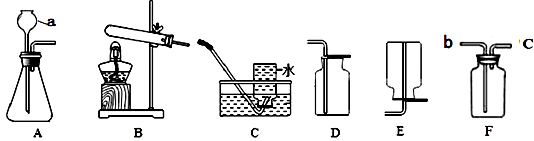
(1)请写出仪器a的名称:。
(2)用氯酸钾和二氧化锰为原料制取较纯净的氧气可选用的装置组合为(填字母,下同),此反应的基本类型为。二氧化锰在反应中的作用是。
(3)小曹老师带领学生进行上述实验时,发现“一同学不慎碰倒装满氧气的集气瓶,迅速扶起后,瓶中剩余的氧气仍能使带火星的木条复燃”;对此,小曹老师让该同学往集气瓶装入半瓶水,再用排水法收集1/2集气瓶的氧气,发现瓶中的氧气也能使带火星木条复燃。
① 用下图方案收集“1/2集气瓶的氧气”,其中最合理的是 (填字母);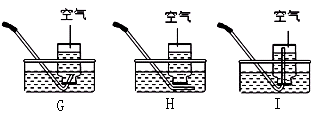
② 用排水法收集气体时,如何判断集气瓶中气体已收集满?答:;
③ 空气中氧气的体积分数约为21%。本实验中,集气瓶内的氧气约占总体积的%,所以用“使带火星木条复燃”来检验集气瓶中充满氧气的方法不可靠。
(4)实验室用大理石和稀盐酸制取二氧化碳,反应的化学方程式是 , 若用F装置收集二氧化碳,气体应从端通入(填“b”或“c”)。
【答案】
(1)长颈漏斗
(2)BC,分解反应,催化
(3)G,集气瓶口向外冒气泡,60.5
(4)CaCO3+2HCl=CaCl2+2H2O+CO2↑,b
【解析】解:(1)仪器a是长颈漏斗。(2)加热固体制取气体选择装置B,用排水法收集的气体较纯净,故选BC 。由一种物质生成三种物质的反应属于分解反应,二氧化锰在此反应中起催化作用。(3) ①用排水法收集气体时,导气管口放在集气瓶口,故选G。②当气泡从集气瓶口向外冒出时说明已经收集满了气体。因为往集气瓶装入半瓶水,收集了 ![]() 体积的氧气,原来
体积的氧气,原来 ![]() 体积空气中氧气的体积是
体积空气中氧气的体积是 ![]() ×21%,故氧气约占总体积的
×21%,故氧气约占总体积的 ![]() +
+ ![]() ×21%= 60.5 % ;(4)实验室制取二氧化碳的化学方程式为 CaCO3+2HCl=CaCl2+2H2O+CO2↑,二氧化碳的密度比空气的密度大,进去以后占据下方空间,空气被排到上方空间,空气从c端易排出,故气体从b端通入。
×21%= 60.5 % ;(4)实验室制取二氧化碳的化学方程式为 CaCO3+2HCl=CaCl2+2H2O+CO2↑,二氧化碳的密度比空气的密度大,进去以后占据下方空间,空气被排到上方空间,空气从c端易排出,故气体从b端通入。
所以答案是:(1)长颈漏斗;(2)BC;分解反应;催化;(3)G;集气瓶口向外冒气泡;60.5;(4)CaCO3+2HCl=CaCl2+2H2O+CO2↑;b。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案