题目内容
由干燥的氯酸钾和二氧化锰组成的固体混合物的质量为30g,把该固体混合物放入大试管中加热,完全反应后,冷却到反应前的温度,称得试管中固体物质的质量为20.4g.
(1)制得氧气的质量是多少克?
(2)原固体混合物中氯酸钾的质量是多少克?
(1)制得氧气的质量是多少克?
(2)原固体混合物中氯酸钾的质量是多少克?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:氯酸钾在二氧化锰的催化作用下受热分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯酸钾的质量.
解答:解:(1)产生氧气的质量为:30g-20.4g=9.6g,
答:生成氧气的质量为9.6g.
(2)设原固体混合物中氯酸钾的质量为x,
2KClO3
2KCl+3O2↑,
245 96
x 9.6g
=
,
x=24.5g,
答:原固体混合物中氯酸钾的质量为24.5g.
答:生成氧气的质量为9.6g.
(2)设原固体混合物中氯酸钾的质量为x,
2KClO3
| ||
| △ |
245 96
x 9.6g
| 245 |
| x |
| 96 |
| 9.6g |
x=24.5g,
答:原固体混合物中氯酸钾的质量为24.5g.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化合物中,铁元素的质量分数最高的是( )
| A、FeCl2 |
| B、Fe3O4 |
| C、Fe2O3 |
| D、FeO |
下列粒子结构示意图中,表示阴离子的是( )
A、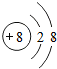 |
B、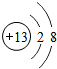 |
C、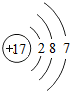 |
D、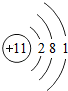 |