题目内容
【题目】为了探究石灰石与稀盐酸反应溶液溶质的成分,取滤液20克于烧杯中搅拌,向其中滴加过量10.6%Na2CO3 , 溶液,有关的变化如图所示。回答下列问题: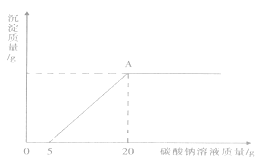
(1)原溶液中的溶质成分有 (填化学式)。
(2)A点处溶质的质量是多少克?(写计算过程)
【答案】
(1)HCl、CaCl2
(2)
解:设碳酸钠与盐酸反应生成的氯化钠质量为X,碳酸钠与氯化钙反应生成的氯化钠质量为y
Na2CO3+2HCl= | 2NaCl+CO2 ↑+2H2O |
106 | 117 |
10.6%x5g | x |
![]()
x=0.585g
Na2CO3+CaCl2=CaCO3 ↓+ | 2NaCl |
106 | 117 |
10.6%x15g | y |
![]()
y=1.755g
故溶液中溶质氯化钠的总质量为:0.585g+1.755g=2.34g
答:A点处溶质氯化钠的质量为2.34g
【解析】解:(1)石灰石与稀盐酸反应的方程式为:CaCO3 +2HCl=CaCl2+H2O+ CO2↑,若完全反应溶质为CaCl2 , 刚开始加入Na2CO3时无沉淀生成,说明溶液中有剩余的HCl,则原溶液中的溶质成分有HCl、CaCl2;(2)0~5处发生的反应为Na2CO3+2HCl=2NaCl+CO2 ↑+2H2O,5~20发生的反应为Na2CO3+CaCl2=CaCO3 ↓+2NaCl,溶质均为NaCl,根据质量守恒可求出NaCl的质量。
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
【题目】下列图中不能正确反映其对应操作的是( )
A | B | C | D |
|
|
|
|
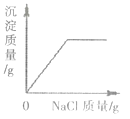
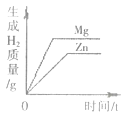
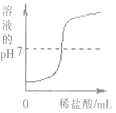
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量的Zn和Mg分别与足量稀H2SO4反应 | 向NaOH溶液中逐滴加入稀HCl | 等质量CaCO3分别与足量稀HCl反应 |
A.A
B.B
C.C
D.D