题目内容
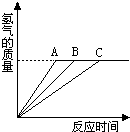
 16、若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如右图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n克)之间的关系是
16、若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如右图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n克)之间的关系是65n/73≤m
或56n/73≤m
.(用不等式表示)分析:根据产生氢气量相同,可知盐酸恰好完全反应或不足;产生2g氢气所消耗的金属质量分别为:铝 27x×2/3=18g,镁 24 g,锌 65 g,铁 56g,而产生2g氢气需要71g的HCl,这里m有个最小值,对金属锌和金属铁分别列式:锌:m/65=n/73,铁:m/56=n/73,题示的任意三种金属中必然有锌或者铁,所以答案会有两种情况,m的最小值也在这两式中取.
解答:解:根据四种金属与盐酸反应的方程式:2Al+6HCl=2AlCl3+3H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,
Fe+2HCl=FeCl2+H2↑,产生2g氢气所消耗的金属质量分别为:铝 27x×2/3=18g,镁 24 g,锌 65 g,铁 56g,而产生2g氢气需要71g的HCl,产生2g氢气各种金属消耗的HCl质量都是73g;这里m有个最小值(产生单位氢气所需消耗的金属质量有最小值) 对金属锌和金属铁分别列式:锌:m/65=n/73,铁:m/56=n/73,题示的任意三种金属中必然有锌或者铁,所以答案会有两种情况,m的最小值也在这两式中取,所以金属与盐酸中溶质质量关系为:65n/73≤m或56n/73≤m.
故答案为:
65n/73≤m或56n/73≤m.
Fe+2HCl=FeCl2+H2↑,产生2g氢气所消耗的金属质量分别为:铝 27x×2/3=18g,镁 24 g,锌 65 g,铁 56g,而产生2g氢气需要71g的HCl,产生2g氢气各种金属消耗的HCl质量都是73g;这里m有个最小值(产生单位氢气所需消耗的金属质量有最小值) 对金属锌和金属铁分别列式:锌:m/65=n/73,铁:m/56=n/73,题示的任意三种金属中必然有锌或者铁,所以答案会有两种情况,m的最小值也在这两式中取,所以金属与盐酸中溶质质量关系为:65n/73≤m或56n/73≤m.
故答案为:
65n/73≤m或56n/73≤m.
点评:本题考查生成等质量氢气时,金属与酸的关系,要掌握金属与酸反应时量的关系.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
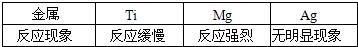
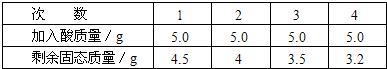
 若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如右图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n克)之间的关系是________或________.(用不等式表示)
若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如右图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n克)之间的关系是________或________.(用不等式表示)